Avandia untuk Pengobatan Diabetes
Nama Merek: AVANDIA
Nama Umum: rosiglitazone maleate
Isi:
Indikasi dan Penggunaan
Dosis dan Administrasi
Bentuk dan Kekuatan Dosis
Kontraindikasi
Peringatan dan pencegahan
Reaksi yang merugikan
Interaksi obat
Gunakan dalam Populasi Tertentu
Overdosis
Deskripsi
Farmakologi Klinis
Toksikologi Nonklinis
Studi Klinis
Bagaimana Disediakan
Avandia, rosiglitazone maleate, informasi pasien (dalam Bahasa Inggris)
PERINGATAN
KEGAGALAN JANTUNG KONGESTIF DAN ISKEMIA MYOCARDIAL
- Thiazolidinediones, termasuk rosiglitazone, menyebabkan atau memperburuk gagal jantung kongestif pada beberapa pasien [lihat PERINGATAN DAN PENCEGAHAN]. Setelah inisiasi AVANDIA, dan setelah dosis meningkat, amati pasien dengan hati-hati untuk tanda dan gejala gagal jantung (termasuk peningkatan berat badan yang cepat, dispnea, dan / atau edema). Jika tanda dan gejala ini berkembang, gagal jantung harus dikelola sesuai dengan standar perawatan saat ini. Lebih lanjut, penghentian atau pengurangan dosis AVANDIA harus dipertimbangkan.
- AVANDIA tidak direkomendasikan pada pasien dengan gagal jantung simptomatik. Inisiasi AVANDIA pada pasien dengan gagal jantung NYHA Kelas III atau IV yang mapan merupakan kontraindikasi. [Lihat KONTRAINDIKASI dan PERINGATAN DAN PENCEGAHAN.]
- Sebuah meta analisis dari 42 studi klinis (rata-rata durasi 6 bulan; 14.237 total pasien), yang sebagian besar membandingkan AVANDIA dengan plasebo, menunjukkan AVANDIA dikaitkan dengan peningkatan risiko kejadian iskemik miokard seperti angina atau infark miokard. Tiga studi lain (rata-rata durasi 41 bulan; 14.067 total pasien), membandingkan AVANDIA dengan beberapa agen antidiabetika oral atau plasebo lain yang disetujui, belum mengkonfirmasi atau mengecualikan risiko ini. Secara keseluruhan, data yang tersedia tentang risiko iskemia miokard tidak dapat disimpulkan. [Lihat PERINGATAN DAN PENCEGAHAN.]
teratas
Indikasi dan Penggunaan
Monoterapi dan Terapi Kombinasi
AVANDIA diindikasikan sebagai tambahan untuk diet dan olahraga untuk meningkatkan kontrol glikemik pada orang dewasa dengan diabetes mellitus tipe 2.
Keterbatasan Penting Penggunaan
- Karena mekanisme kerjanya, AVANDIA hanya aktif dengan adanya insulin endogen. Oleh karena itu, AVANDIA tidak boleh digunakan pada pasien dengan diabetes mellitus tipe 1 atau untuk pengobatan ketoasidosis diabetikum.
- Pemberian AVANDIA dan insulin secara bersamaan tidak dianjurkan.
- Penggunaan AVANDIA dengan nitrat tidak dianjurkan.
teratas
Dosis dan Administrasi
Manajemen terapi antidiabetik harus individual. Semua pasien harus memulai AVANDIA dengan dosis rekomendasi terendah. Peningkatan lebih lanjut dalam dosis AVANDIA harus disertai dengan pemantauan cermat untuk efek samping terkait dengan retensi cairan [lihat Peringatan Kotak dan Peringatan dan pencegahan].
AVANDIA dapat diberikan dengan dosis awal 4 mg baik sebagai dosis harian tunggal atau dalam 2 dosis terbagi. Untuk pasien yang merespon tidak cukup setelah 8 sampai 12 minggu perawatan, sebagaimana ditentukan oleh pengurangan glukosa plasma puasa (FPG), dosis dapat ditingkatkan menjadi 8 mg setiap hari sebagai monoterapi atau dalam kombinasi dengan metformin, sulfonylurea, atau sulfonylurea plus metformin. Penurunan parameter glikemik dengan dosis dan rejimen dijelaskan dalam Studi Klinis. AVANDIA dapat dikonsumsi dengan atau tanpa makanan.
Total dosis harian AVANDIA tidak boleh lebih dari 8 mg.
Monoterapi
Dosis awal AVANDIA yang biasa adalah 4 mg diberikan baik sebagai dosis tunggal sekali sehari atau dalam dosis terbagi dua kali sehari. Dalam uji klinis, rejimen 4 mg dua kali sehari menghasilkan penurunan FPG dan hemoglobin A1c (HbA1c) terbesar.
Kombinasi dengan Sulfonylurea atau Metformin
Ketika AVANDIA ditambahkan ke terapi yang ada, dosis agen saat ini dapat dilanjutkan setelah mulai terapi dengan AVANDIA.
Sulfonylurea: Ketika digunakan dalam kombinasi dengan sulfonylurea, dosis awal AVANDIA yang biasa adalah 4 mg diberikan sebagai dosis tunggal sekali sehari atau dalam dosis terbagi dua kali sehari. Jika pasien melaporkan hipoglikemia, dosis sulfonilurea harus dikurangi.
Metformin: Dosis awal AVANDIA yang biasa dalam kombinasi dengan metformin diberikan 4 mg baik sebagai dosis tunggal sekali sehari atau dalam dosis terbagi dua kali sehari. Tidak mungkin bahwa dosis metformin akan membutuhkan penyesuaian karena hipoglikemia selama terapi kombinasi dengan AVANDIA.
Kombinasi Dengan Sulfonylurea Plus Metformin
Dosis awal AVANDIA yang biasa dalam kombinasi dengan sulfonylurea plus metformin diberikan 4 mg sebagai dosis tunggal sekali sehari atau dosis terbagi dua kali sehari. Jika pasien melaporkan hipoglikemia, dosis sulfonilurea harus dikurangi.
Populasi Pasien Tertentu
Gangguan ginjal: Tidak diperlukan penyesuaian dosis ketika AVANDIA digunakan sebagai monoterapi pada pasien dengan gangguan ginjal. Karena metformin merupakan kontraindikasi pada pasien tersebut, pemberian metformin dan AVANDIA secara bersamaan juga dikontraindikasikan pada pasien dengan gangguan ginjal.
Gangguan hati: Enzim hati harus diukur sebelum memulai pengobatan dengan AVANDIA. Terapi dengan AVANDIA tidak boleh dimulai jika pasien menunjukkan bukti klinis aktif penyakit hati atau peningkatan kadar transaminase serum (ALT> 2.5X batas atas normal pada awal terapi). Setelah inisiasi AVANDIA, enzim hati harus dipantau secara berkala sesuai penilaian klinis profesional kesehatan. [Lihat Peringatan dan pencegahan dan FARMAKOLOGI KLINIS.]
Anak: Data tidak cukup untuk merekomendasikan penggunaan AVANDIA pediatrik [lihat GUNAKAN dalam POPULASI KHUSUS].
teratas
Bentuk dan Kekuatan Dosis
Tablet TILTAB berlapis film pentagonal mengandung rosiglitazone sebagai maleat sebagai berikut:
- 2 mg - merah muda, debossed dengan SB di satu sisi dan 2 di sisi lain
- 4 mg - oranye, debossed dengan SB di satu sisi dan 4 di sisi lain
- 8 mg - merah-coklat, debossed dengan SB di satu sisi dan 8 di sisi lain
teratas
Kontraindikasi
Inisiasi AVANDIA pada pasien dengan gagal jantung New York Heart Association (NYHA) Kelas III atau IV merupakan kontraindikasi [lihat PERINGATAN KOTAK].
teratas
Peringatan dan pencegahan
Gagal Jantung
AVANDIA, seperti tiazolidinediones lain, sendirian atau dalam kombinasi dengan agen antidiabetik lainnya, dapat menyebabkan retensi cairan, yang dapat memperburuk atau menyebabkan gagal jantung. Pasien harus diamati untuk tanda dan gejala gagal jantung. Jika tanda dan gejala ini berkembang, gagal jantung harus dikelola sesuai dengan standar perawatan saat ini. Selanjutnya, penghentian atau pengurangan dosis rosiglitazone harus dipertimbangkan [lihat PERINGATAN KOTAK].
Pasien dengan gagal jantung kongestif (CHF) NYHA Kelas I dan II yang diobati dengan AVANDIA memiliki peningkatan risiko kejadian kardiovaskular. Sebuah studi ekokardiografi 52 minggu, double-blind, terkontrol plasebo dilakukan pada 224 pasien dengan tipe 2 diabetes mellitus dan NYHA Kelas I atau II CHF (fraksi ejeksi â ‰ ¤ 45%) dengan latar belakang antidiabetes dan CHF terapi. Sebuah komite independen melakukan evaluasi secara buta terhadap peristiwa-peristiwa yang berhubungan dengan cairan (termasuk gagal jantung kongestif) dan rawat inap kardiovaskular sesuai dengan kriteria yang telah ditentukan (pengadilan). Terpisah dari ajudikasi, efek samping kardiovaskular lainnya dilaporkan oleh para peneliti. Meskipun tidak ada perbedaan perlakuan dalam perubahan dari baseline fraksi ejeksi yang diamati, lebih banyak efek samping kardiovaskular diamati setelah perawatan dengan AVANDIA dibandingkan dengan plasebo selama Studi 52 minggu. (Lihat Tabel 1.)
Tabel 1. Kejadian Buruk Kardiovaskular Emergen pada Pasien dengan Gagal Jantung Kongestif (NYHA Kelas I dan II) Diobati dengan AVANDIA atau Plasebo (Selain Terapi Antidiabetik dan CHF Latar Belakang)
| Acara | AVANDIA N = 110 n (%) |
Placebo N = 114 n (%) |
| Diadjudikasi | ||
| Kematian kardiovaskular | 5 (5%) | 4 (4%) |
| CHF memburuk | 7 (6%) | 4 (4%) |
| - dengan rawat inap semalam | 5 (5%) | 4 (4%) |
| - tanpa menginap di rumah sakit | 2 (2%) | 0 (0%) |
| Edema baru atau memburuk | 28 (25%) | 10 (9%) |
| Dispnea baru atau memburuk | 29 (26%) | 19 (17%) |
| Peningkatan pengobatan CHF | 36 (33%) | 20 (18%) |
| Rawat inap kardiovaskular * | 21 (19%) | 15 (13%) |
| Investigator dilaporkan, tidak diadili | ||
| Efek samping iskemik | 10 (9%) | 5 (4%) |
| - Infark miokard | 5 (5%) | 2 (2%) |
| - Angina | 6 (5%) | 3 (3%) |
| * Termasuk rawat inap karena alasan kardiovaskular. |
Inisiasi AVANDIA pada pasien dengan gagal jantung NYHA Kelas III atau IV yang mapan merupakan kontraindikasi. AVANDIA tidak direkomendasikan pada pasien dengan gagal jantung simptomatik. [Lihat PERINGATAN KOTAK.]
Pasien yang mengalami sindrom koroner akut belum diteliti dalam uji klinis terkontrol. Mengingat potensi perkembangan gagal jantung pada pasien yang memiliki kejadian koroner akut, inisiasi AVANDIA tidak direkomendasikan untuk pasien yang mengalami kejadian koroner akut, dan penghentian AVANDIA selama fase akut ini seharusnya dipertimbangkan.
Pasien dengan status jantung NYHA Kelas III dan IV (dengan atau tanpa CHF) belum diteliti dalam uji klinis terkontrol. AVANDIA tidak direkomendasikan pada pasien dengan status jantung NYHA Kelas III dan IV.
Iskemia miokard
Analisis Meta Iskemia Myokardial dalam Kelompok 42 Uji Klinis
Sebuah meta-analisis dilakukan secara retrospektif untuk menilai efek samping kardiovaskular yang dilaporkan di 42 uji klinis acak ganda, terkontrol (durasi rata-rata 6 bulan).1
Studi-studi ini telah dilakukan untuk menilai kemanjuran penurun glukosa pada diabetes tipe 2, dan ajudikasi kejadian kardiovaskular yang direncanakan secara prospektif belum terjadi dalam uji coba. Beberapa percobaan dikontrol plasebo dan beberapa menggunakan obat antidiabetik oral aktif sebagai kontrol. Studi terkontrol plasebo termasuk uji monoterapi (monoterapi dengan AVANDIA versus monoterapi plasebo) dan uji coba tambahan (AVANDIA atau plasebo, ditambahkan ke sulfonylurea, metformin, atau insulin). Studi kontrol aktif termasuk uji monoterapi (monoterapi dengan AVANDIA versus sulfonylurea atau metformin monoterapi) dan uji coba tambahan (AVANDIA plus sulfonylurea atau AVANDIA plus metformin, dibandingkan sulfonylurea plus metformin). Sebanyak 14.237 pasien dilibatkan (8.604 dalam kelompok pengobatan yang mengandung AVANDIA, 5.633 di kelompok pembanding), dengan paparan 4.143 pasien-tahun ke AVANDIA dan 2.675 pasien-tahun pajanan pembanding. Peristiwa iskemik miokard termasuk angina pektoris, angina pektoris diperburuk, angina tidak stabil, henti jantung, nyeri dada, koroner oklusi arteri, dispnea, infark miokard, trombosis koroner, iskemia miokard, penyakit arteri koroner, dan arteri koroner kekacauan. Dalam analisis ini, peningkatan risiko iskemia miokard dengan AVANDIA dibandingkan dengan komparator gabungan diamati (2% AVANDIA versus pembanding 1,5%, rasio odds 1,4, interval kepercayaan 95% [CI] 1,1, 1.8). Peningkatan risiko kejadian iskemik miokard dengan AVANDIA diamati dalam studi yang dikendalikan plasebo, tetapi tidak dalam penelitian yang dikendalikan secara aktif. (Lihat Gambar 1.)
Peningkatan risiko yang lebih besar dari kejadian iskemik miokard diamati pada penelitian di mana AVANDIA ditambahkan ke insulin (2,8% untuk AVANDIA plus insulin versus 1,4% untuk plasebo plus insulin, [OR 2,1, 95% CI 0,9, 5.1]). Peningkatan risiko ini mencerminkan perbedaan 3 peristiwa per 100 pasien-tahun (95% CI -0,1, 6,3) antara kelompok perlakuan. [Lihat PERINGATAN DAN PENCEGAHAN.]
Gambar 1. Forest Plot of Odds Ratios (Interval Kepercayaan 95%) untuk Peristiwa Isokemik Miokard dalam Meta-Analisis dari 42 Uji Klinis
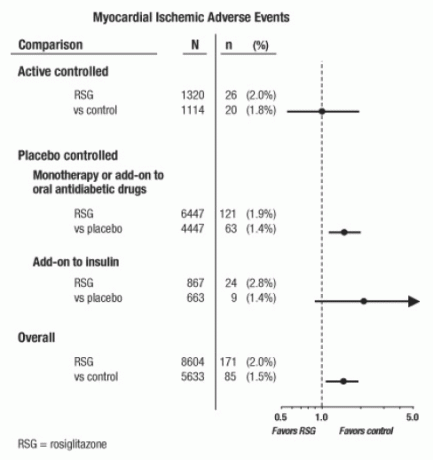
Peningkatan risiko iskemia miokard yang lebih besar juga diamati pada pasien yang menerima AVANDIA dan terapi latar belakang nitrat. Untuk AVANDIA (N = 361) versus kontrol (N = 244) pada pengguna nitrat, rasio odds adalah 2,9 (95% CI 1,4, 5,9), sementara untuk pengguna non-nitrat (total sekitar 14.000 pasien), rasio odds adalah 1,3 (95% CI 0,9, 1.7). Peningkatan risiko ini mewakili perbedaan 12 kejadian iskemik miokard per 100 pasien-tahun (95% CI 3,3, 21,4). Sebagian besar pengguna nitrat mengidap penyakit jantung koroner. Di antara pasien dengan penyakit jantung koroner yang diketahui tidak menggunakan terapi nitrat, peningkatan risiko kejadian iskemik miokard untuk AVANDIA versus pembanding tidak ditunjukkan.
Peristiwa Iskemik Miokard dalam Uji Coba prospektif Jangka Panjang yang Besar dari AVANDIA
Data dari 3 uji klinis besar lainnya, jangka panjang, prospektif, acak, terkontrol dari AVANDIA dinilai secara terpisah dari meta-analisis. 3 uji coba ini mencakup total 14.067 pasien (kelompok pengobatan yang mengandung AVANDIA N = 6.311, pembanding kelompok N = 7.756), dengan paparan pasien-tahun 21.803 pasien-tahun untuk AVANDIA dan 25.998 pasien-tahun untuk pembanding. Durasi tindak lanjut melebihi 3 tahun dalam setiap studi. ADOPT (Uji Coba Perkembangan Hasil Diabetes) adalah studi acak terkontrol aktif selama 4-6 tahun pada pasien yang baru didiagnosis dengan diabetes tipe 2 naif terhadap terapi obat.
Itu adalah uji coba kemanjuran dan keselamatan umum yang dirancang untuk menguji daya tahan
AVANDIA sebagai monoterapi (N = 1.456) untuk kontrol glikemik pada diabetes tipe 2, dengan lengan pembanding monoterapi sulfonylurea (N = 1.441) dan metformin monoterapi (N = 1.454). DREAM (Penilaian Pengurangan Diabetes dengan Obat Rosiglitazone dan Ramipril, diterbitkan report2) adalah 3- untuk Studi acak terkontrol plasebo selama 5 tahun pada pasien dengan toleransi glukosa dan / atau puasa terganggu glukosa. Itu memiliki desain faktorial 2x2, dimaksudkan untuk mengevaluasi efek AVANDIA, dan secara terpisah ramipril (sebuah penghambat enzim pengonversi angiotensin [ACEI]), pada pengembangan menjadi diabetes terbuka. Dalam DREAM, 2.635 pasien berada dalam kelompok pengobatan yang mengandung AVANDIA, dan 2.634 berada dalam kelompok perlakuan yang tidak mengandung AVANDIA.Hasil Interim telah dipublikasikan 3 untuk RECORD (Rosiglitazone Dievaluasi untuk Hasil Jantung dan Regulasi Glikemia di Diabetes), studi kardiovaskular terbuka label 6 tahun yang sedang berlangsung pada pasien dengan diabetes tipe 2 dengan pengobatan rata-rata Durasi 3,75 tahun. RECORD termasuk pasien yang gagal monoterapi metformin atau sulfonylurea; mereka yang gagal metformin diacak untuk menerima add-on AVANDIA atau add-on sulfonylurea, dan mereka yang gagal sulfonylurea diacak untuk menerima add-on AVANDIA atau add-on metformin. Dalam RECORD, total 2.220 pasien menerima add-on AVANDIA, dan 2.227 pasien berada di salah satu rejimen add-on yang tidak mengandung AVANDIA.
Untuk 3 percobaan ini, analisis dilakukan dengan menggunakan gabungan dari kejadian kardiovaskular yang merugikan utama (infark miokard, kematian kardiovaskular, atau stroke), selanjutnya disebut MACE. Titik akhir ini berbeda dari titik akhir luas meta-analisis 'dari kejadian iskemik miokard, lebih dari setengahnya adalah angina. Infark miokardium termasuk infark miokard fatal dan nonfatal yang diputuskan ditambah kematian mendadak. Seperti yang ditunjukkan pada Gambar 2, hasil untuk 3 titik akhir (MACE, MI, dan Total Mortality) tidak berbeda secara statistik antara AVANDIA dan pembanding.

Dalam analisis awal percobaan MIMPI, kejadian kejadian kardiovaskular lebih tinggi di antara subyek yang menerima AVANDIA dalam kombinasi dengan ramipril daripada di antara subyek yang menerima ramipril saja, seperti yang diilustrasikan dalam Gambar 2. Temuan ini tidak dikonfirmasi dalam ADOPT dan RECORD (percobaan terkontrol aktif pada pasien dengan diabetes) di mana masing-masing 30% dan 40% pasien, melaporkan penggunaan ACE-inhibitor pada awal.
Secara keseluruhan, data yang tersedia tentang risiko iskemia miokard tidak dapat disimpulkan. Kesimpulan definitif mengenai risiko ini menunggu penyelesaian studi hasil kardiovaskular yang dirancang secara memadai.
Belum ada penelitian klinis yang membuktikan bukti pengurangan risiko makrovaskular dengan AVANDIA atau obat antidiabetik oral lainnya.
Gagal Jantung Kongestif dan Iskemia Miokardial Selama Coadministrasi AVANDIA dengan Insulin
Dalam studi di mana AVANDIA ditambahkan ke insulin, AVANDIA meningkatkan risiko gagal jantung kongestif dan iskemia miokard. (Lihat Tabel 2.)
Pemberian AVANDIA dan insulin secara bersamaan tidak dianjurkan. [Lihat Indikasi dan Penggunaan dan PERINGATAN DAN PENCEGAHAN.]
Dalam lima, 26 minggu, uji coba terkontrol, acak, buta ganda yang dimasukkan dalam meta-analisis [lihat PERINGATAN DAN PENCEGAHAN], pasien dengan diabetes mellitus tipe 2 secara acak diberikan bersama AVANDIA dan insulin (N = 867) atau insulin (N = 663). Dalam 5 percobaan ini, AVANDIA ditambahkan ke insulin. Percobaan ini termasuk pasien dengan diabetes yang sudah berlangsung lama (durasi rata-rata 12 tahun) dan prevalensi tinggi yang sudah ada sebelumnya kondisi medis, termasuk neuropati perifer, retinopati, penyakit jantung iskemik, penyakit pembuluh darah, dan jantung kongestif kegagalan. Jumlah total pasien dengan gagal jantung kongestif yang muncul adalah 21 (2,4%) dan 7 (1,1%) di AVANDIA plus insulin dan kelompok insulin, masing-masing. Jumlah total pasien dengan iskemia miokard yang muncul adalah 24 (2,8%) dan 9 (1,4%) masing-masing dalam AVANDIA plus kelompok insulin dan insulin, masing-masing (OR 2,1 [95% CI 0,9, 5,1]). Meskipun tingkat kejadian gagal jantung kongestif dan iskemia miokard rendah dalam penelitian ini populasi, secara konsisten tingkat kejadian adalah 2 kali lipat atau lebih tinggi dengan administrasi AVANDIA dan insulin. Kejadian kardiovaskular ini dicatat pada AVANDIA dosis 4 mg dan 8 mg setiap hari. (Lihat Tabel 2.)
Meja 2. Kejadian Kejadian Kardiovaskular di 5 Uji Coba Terkontrol Penambahan AVANDIA pada Pengobatan Insulin yang Telah Mapan
| Peristiwa* | AVANDIA + Insulin (n = 867) n (%) |
Insulin (n = 663) n (%) |
| Gagal jantung kongestif | 21 (2.4%) | 7 (1.1%) |
| Iskemia miokard | 24 (2.8%) | 9 (1.4%) |
| Komposit kematian kardiovaskular, infark miokard, atau stroke | 10 (1.2%) | 5 (0.8%) |
| Pukulan | 5 (0.6%) | 4 (0.6%) |
| Infark miokard | 4 (0.5%) | 1 (0.2%) |
| Kematian kardiovaskular | 4 (0.5%) | 1 (0.2%) |
| Semua kematian | 6 (0.7%) | 1 (0.2%) |
| * Acara tidak eksklusif; yaitu, pasien dengan kematian kardiovaskular karena infark miokard akan dihitung dalam 4 kategori peristiwa (iskemia miokard; kematian kardiovaskular, infark miokard atau stroke; infark miokard; kematian kardiovaskular). |
Dalam uji coba keenam, 24 minggu, terkontrol, acak, dan tersamar ganda dari AVANDIA dan coadministrasi insulin, insulin ditambahkan ke AVANDAMET® (rosiglitazone maleat dan metformin HCl) (n = 161) dan dibandingkan dengan insulin plus plasebo (n = 158), setelah 8 minggu pengobatan single-blind dengan AVANDAMET. Pasien dengan edema yang membutuhkan terapi farmakologis dan mereka yang gagal jantung kongestif dikeluarkan pada awal dan selama periode berjalan.
Pada kelompok yang menerima AVANDAMET plus insulin, ada satu kejadian iskemik miokard dan satu kematian mendadak. Tidak ada iskemia miokard yang diamati pada kelompok insulin, dan tidak ada gagal jantung kongestif yang dilaporkan pada kedua kelompok perlakuan.
Busung
AVANDIA harus digunakan dengan hati-hati pada pasien dengan edema. Dalam sebuah studi klinis pada sukarelawan sehat yang menerima 8 mg AVANDIA sekali sehari selama 8 minggu, ada peningkatan yang signifikan secara statistik dalam volume plasma rata-rata dibandingkan dengan plasebo.
Karena tiazolidinediones, termasuk rosiglitazone, dapat menyebabkan retensi cairan, yang dapat memperburuk atau menyebabkan gagal jantung kongestif, AVANDIA harus digunakan dengan hati-hati pada pasien yang berisiko mengalami jantung kegagalan. Pasien harus dimonitor untuk tanda dan gejala gagal jantung [lihat PERINGATAN KOTAK, PERINGATAN DAN PENCEGAHAN ].
Dalam uji klinis terkontrol pasien dengan diabetes tipe 2, edema ringan sampai sedang dilaporkan pada pasien yang diobati dengan AVANDIA, dan mungkin terkait dosis. Pasien dengan edema yang berkelanjutan lebih cenderung memiliki efek samping yang terkait dengan edema jika mulai dengan terapi kombinasi dengan insulin dan AVANDIA [lihat ADVERSE REACTIONS].
Berat badan
Kenaikan berat badan terkait dosis terlihat dengan AVANDIA saja dan dalam kombinasi dengan agen hipoglikemik lainnya (Tabel 3). Mekanisme penambahan berat badan tidak jelas tetapi mungkin melibatkan kombinasi retensi cairan dan akumulasi lemak.
Dalam pengalaman pasca pemasaran, telah ada laporan tentang peningkatan berat badan yang luar biasa cepat dan peningkatan kelebihan yang umumnya diamati dalam uji klinis. Pasien yang mengalami peningkatan tersebut harus dinilai untuk akumulasi cairan dan kejadian terkait volume seperti edema berlebihan dan gagal jantung kongestif [lihat PERINGATAN KOTAK].
Tabel 3. Perubahan Berat (kg) Dari Baseline di Endpoint Selama Uji Klinis
| Monoterapi | Durasi | Kelompok Kontrol | AVANDIA 4 mg Median (25, 75 persentil) |
AVANDIA 8 mg Median (25, 75 persentil) |
|
| Median (25, 75 persentil) | |||||
| 26 minggu | plasebo | -0.9 (-2.8, 0.9) n = 210 |
1.0 (-0.9, 3.6) n = 436 |
3.1 (1.1, 5.8) n = 439 |
|
| 52 minggu | sulfonilurea | 2.0 (0, 4.0) n = 173 |
2.0 (-0.6, 4.0) n = 150 |
2.6 (0, 5.3) n = 157 |
|
| Terapi kombinasi | |||||
| Sulfonylurea | 24-26 minggu | sulfonilurea | 0 (-1.0, 1.3) n = 1.155 |
2.2 (0.5, 4.0) n = 613 |
3.5 (1.4, 5.9) n = 841 |
| Metformin | 26 minggu | metformin | -1.4 (-3.2, 0.2) n = 175 |
0.8 (-1.0, 2.6) n = 100 |
2.1 (0, 4.3) n = 184 |
| Insulin | 26 minggu | insulin | 0.9 (-0.5, 2.7) n = 162 |
4.1 (1.4, 6.3) n = 164 |
5.4 (3.4, 7.3) n = 150 |
| Sulfonylurea + metformin | 26 minggu | sulfonylurea + metformin | 0.2 (-1.2, 1.6) n = 272 |
2.5 (0.8, 4.6) n = 275 |
4.5 (2.4, 7.3) n = 276 |
Dalam 4-6 tahun, monoterapi, uji komparatif (ADOPT) pada pasien yang baru didiagnosis dengan diabetes tipe 2 yang sebelumnya tidak diobati dengan obat antidiabetik [lihat Studi Kliniss], median perubahan berat badan (25th, 75th persentil) dari awal pada 4 tahun adalah 3,5 kg (0,0, 8,1) untuk AVANDIA, 2,0 kg (-1,0, 4,8) untuk glyburide, dan -2,4 kg (-5,4, 0,5) untuk metformin.
Dalam studi 24 minggu pada pasien anak-anak berusia 10 hingga 17 tahun yang diobati dengan AVANDIA 4 hingga 8 mg setiap hari, peningkatan berat badan rata-rata 2,8 kg (25th, 75th persentil: 0,0, 5,8) dilaporkan.
Efek hati
Enzim hati harus diukur sebelum dimulainya terapi dengan AVANDIA pada semua pasien dan setelahnya secara periodik per penilaian klinis profesional kesehatan. Terapi dengan AVANDIA tidak boleh dimulai pada pasien dengan peningkatan kadar enzim hati awal (ALT> 2.5X batas atas normal). Pasien dengan enzim hati yang sedikit meningkat (kadar ALT ‰ ¤ batas atas 2.5X normal) pada awal atau selama terapi dengan AVANDIA harus dievaluasi untuk menentukan penyebab enzim hati ketinggian. Inisiasi, atau kelanjutan dari, terapi dengan AVANDIA pada pasien dengan peningkatan enzim hati ringan harus dilanjutkan dengan hati-hati dan termasuk tindak lanjut klinis yang dekat, termasuk pemantauan enzim hati, untuk menentukan apakah peningkatan enzim hati menyelesaikan atau memburuk. Jika sewaktu-waktu kadar ALT meningkat hingga> 3X batas atas normal pada pasien yang menjalani terapi dengan AVANDIA, kadar enzim hati harus diperiksa ulang sesegera mungkin. Jika kadar ALT tetap> 3X batas atas normal, terapi dengan AVANDIA harus dihentikan.
Jika ada pasien yang mengalami gejala yang menunjukkan disfungsi hati, yang mungkin termasuk mual yang tidak dapat dijelaskan, muntah, sakit perut, kelelahan, anoreksia dan / atau urin gelap, enzim hati harus diperiksa. Keputusan apakah akan melanjutkan pasien dengan terapi dengan AVANDIA harus dipandu oleh penilaian klinis sambil menunggu evaluasi laboratorium. Jika penyakit kuning diamati, terapi obat harus dihentikan. [Lihat ADVERSE REACTIONS.]
Edema Makula
Edema makula telah dilaporkan dalam pengalaman pasca pemasaran pada beberapa pasien diabetes yang menggunakan AVANDIA atau thiazolidinedione lainnya. Beberapa pasien mengalami penglihatan kabur atau penurunan ketajaman visual, tetapi beberapa pasien tampaknya telah didiagnosis pada pemeriksaan opthalmologis rutin. Sebagian besar pasien mengalami edema perifer pada saat edema makula didiagnosis. Beberapa pasien mengalami peningkatan edema makula setelah penghentian thiazolidinedione mereka. Pasien dengan diabetes harus menjalani pemeriksaan mata secara teratur oleh dokter mata, sesuai dengan Standar Perawatan American Diabetes Association. Selain itu, setiap penderita diabetes yang melaporkan segala jenis gejala visual harus segera dirujuk ke dokter spesialis mata, terlepas dari obat yang mendasari pasien atau temuan fisik lainnya. [Lihat ADVERSE REACTIONS.]
Patah tulang
Dalam studi banding 4-6 tahun (ADOPT) tentang kontrol glikemik dengan monoterapi pada pasien yang belum pernah menggunakan obat baru-baru ini didiagnosis dengan diabetes mellitus tipe 2, peningkatan insiden patah tulang tercatat pada pasien wanita yang memakai AVANDIA. Selama periode 4 hingga 6 tahun, insidensi fraktur tulang pada wanita adalah 9,3% (60/645) untuk AVANDIA dibandingkan 3,5% (21/605) untuk glyburide dan 5,1% (30/590) untuk metformin. Peningkatan kejadian ini dicatat setelah tahun pertama pengobatan dan bertahan selama penelitian. Sebagian besar fraktur pada wanita yang menerima AVANDIA terjadi di lengan atas, tangan, dan kaki. Situs fraktur ini berbeda dari yang biasanya dikaitkan dengan osteoporosis pascamenopause (mis. Pinggul atau tulang belakang). Tidak ada peningkatan dalam tingkat fraktur yang diamati pada pria yang diobati dengan AVANDIA. Risiko patah tulang harus dipertimbangkan dalam perawatan pasien, terutama pasien wanita, diobati dengan AVANDIA, dan perhatian diberikan untuk menilai dan menjaga kesehatan tulang sesuai dengan standar saat ini peduli.
Efek Hematologi
Penurunan rata-rata hemoglobin dan hematokrit terjadi dalam cara yang berhubungan dengan dosis pada pasien dewasa yang diobati dengan AVANDIA [lihat ADVERSE REACTIONS]. Perubahan yang diamati mungkin terkait dengan peningkatan volume plasma yang diamati dengan pengobatan dengan AVANDIA.
Diabetes dan Kontrol Glukosa Darah
Pasien yang menerima AVANDIA dalam kombinasi dengan agen hipoglikemik lain mungkin berisiko hipoglikemia, dan pengurangan dosis agen bersamaan mungkin diperlukan.
Pengukuran glukosa darah puasa dan HbA1c berkala harus dilakukan untuk memantau respons terapeutik.
Ovulasi
Terapi dengan AVANDIA, seperti tiazolidinediones lainnya, dapat menyebabkan ovulasi pada beberapa wanita anovulasi premenopause. Akibatnya, pasien-pasien ini mungkin berisiko lebih tinggi untuk hamil saat menggunakan AVANDIA [lihat Gunakan dalam Populasi Tertentu]. Dengan demikian, kontrasepsi yang memadai pada wanita premenopause harus direkomendasikan. Efek yang mungkin ini belum diselidiki secara khusus dalam studi klinis; oleh karena itu, frekuensi kejadian ini tidak diketahui.
Meskipun ketidakseimbangan hormon telah terlihat dalam studi praklinis [lihat Toksikologi Nonklinis], signifikansi klinis dari temuan ini tidak diketahui. Jika disfungsi menstruasi yang tidak terduga terjadi, manfaat terapi lanjutan dengan AVANDIA harus ditinjau.
teratas
Reaksi yang merugikan
Pengalaman Uji Coba Klinis
Dewasa
Dalam uji klinis, sekitar 9.900 pasien dengan diabetes tipe 2 telah diobati dengan AVANDIA.
Uji Coba Jangka Pendek dari AVANDIA sebagai Monoterapi dan dalam Kombinasi dengan Agen Hipoglikemik Lainnya
Insiden dan jenis efek samping yang dilaporkan dalam uji klinis jangka pendek AVANDIA sebagai monoterapi ditunjukkan pada Tabel 4.
Tabel 4. Kejadian yang Tidak Diinginkan (â ‰ ¥ 5% dalam Kelompok Perawatan Apa Pun) Dilaporkan oleh Pasien dalam Jangka Pendek * Uji Klinis Buta Ganda Dengan AVANDIA sebagai Monoterapi
| Istilah yang dipilih | AVANDIA Monoterapi N = 2.526 % |
Placebo N = 601 % |
Metformin N = 225 % |
Sulfonylureasâ € N = 626 % |
| Infeksi saluran pernapasan atas | 9.9 | 8.7 | 8.9 | 7.3 |
| Cedera | 7.6 | 4.3 | 7.6 | 6.1 |
| Sakit kepala | 5.9 | 5.0 | 8.9 | 5.4 |
| Sakit punggung | 4.0 | 3.8 | 4.0 | 5.0 |
| Hiperglikemia | 3.9 | 5.7 | 4.4 | 8.1 |
| Kelelahan | 3.6 | 5.0 | 4.0 | 1.9 |
| Radang dlm selaput lendir | 3.2 | 4.5 | 5.3 | 3.0 |
| Diare | 2.3 | 3.3 | 15.6 | 3.0 |
| Hipoglikemia | 0.6 | 0.2 | 1.3 | 5.9 |
|
* Uji coba jangka pendek berkisar antara 8 minggu hingga 1 tahun. †Termasuk pasien yang menerima glyburide (N = 514), gliclazide (N = 91), atau glipizide (N = 21). |
Secara keseluruhan, jenis-jenis reaksi merugikan tanpa mempertimbangkan hubungan sebab akibat dilaporkan ketika AVANDIA digunakan dalam kombinasi dengan sulfonylurea atau metformin mirip dengan yang selama monoterapi dengan AVANDIA.
Kejadian anemia dan edema cenderung dilaporkan lebih sering pada dosis yang lebih tinggi, dan umumnya tingkat keparahannya ringan sampai sedang dan biasanya tidak memerlukan penghentian pengobatan dengan AVANDIA.
Dalam studi double-blind, anemia dilaporkan pada 1,9% pasien yang menerima AVANDIA sebagai monoterapi dibandingkan dengan 0,7% pada plasebo, 0,6% pada sulfonilurea, dan 2,2% pada metformin. Laporan anemia lebih besar pada pasien yang diobati dengan kombinasi AVANDIA dan metformin (7,1%) dan dengan kombinasi AVANDIA dan sulfonylurea plus metformin (6,7%) dibandingkan dengan monoterapi dengan AVANDIA atau dalam kombinasi dengan sulfonylurea (2.3%). Tingkat hemoglobin / hematokrit pra-perawatan yang lebih rendah pada pasien yang terdaftar dalam uji klinis kombinasi metformin mungkin telah berkontribusi pada tingkat pelaporan anemia yang lebih tinggi dalam penelitian ini [lihat ADVERSE REACTIONS].
Dalam uji klinis, edema dilaporkan pada 4,8% pasien yang menerima AVANDIA sebagai monoterapi dibandingkan dengan 1,3% pada plasebo, 1,0% pada sulfonilurea, dan 2,2% pada metformin. Tingkat pelaporan edema lebih tinggi untuk AVANDIA 8 mg dalam kombinasi sulfonylurea (12,4%) dibandingkan dengan kombinasi lain, dengan pengecualian insulin. Edema dilaporkan pada 14,7% pasien yang menerima AVANDIA dalam uji coba kombinasi insulin dibandingkan dengan 5,4% pada insulin saja. Laporan onset baru atau eksaserbasi gagal jantung kongestif terjadi pada tingkat 1% untuk insulin saja, dan 2% (4 mg) dan 3% (8 mg) untuk insulin dalam kombinasi dengan AVANDIA [lihat PERINGATAN KOTAK dan PERINGATAN DAN PENCEGAHAN].
Dalam studi terapi kombinasi terkontrol dengan sulfonilurea, gejala hipoglikemik ringan hingga sedang, yang tampaknya terkait dengan dosis, dilaporkan. Beberapa pasien ditarik karena hipoglikemia (<1%) dan beberapa episode hipoglikemia dianggap parah (<1%). Hipoglikemia adalah efek samping yang paling sering dilaporkan dalam uji kombinasi insulin dosis tetap, walaupun beberapa pasien mengundurkan diri karena hipoglikemia (4 dari 408 untuk AVANDIA plus insulin dan 1 dari 203 untuk insulin sendirian). Tingkat hipoglikemia, dikonfirmasi oleh konsentrasi glukosa darah kapiler â ‰ ¤ 50 mg / dL, adalah 6% untuk insulin saja dan 12% (4 mg) dan 14% (8 mg) untuk insulin dalam kombinasi dengan AVANDIA. [Lihat PERINGATAN DAN PENCEGAHAN.]
Percobaan Jangka Panjang AVANDIA sebagai Monoterapi
Sebuah studi 4-6 tahun (ADOPT) membandingkan penggunaan AVANDIA (n = 1.456), glyburide (n = 1.441), dan metformin (n = 1.454) sebagai monoterapi pada pasien yang baru didiagnosis dengan diabetes tipe 2 yang sebelumnya tidak diobati dengan antidiabetik obat. Tabel 5 menyajikan reaksi merugikan tanpa memperhatikan kausalitas; tingkat dinyatakan per 100 paparan pasien-tahun (PY) untuk memperhitungkan perbedaan dalam paparan obat studi di 3 kelompok perlakuan.
Pada ADOPT, fraktur dilaporkan pada lebih banyak wanita yang diobati dengan AVANDIA (9,3%, 2,7 / 100 pasien-tahun) dibandingkan dengan glyburide (3,5%, 1,3 / 100 pasien-tahun) atau metformin (5,1%, 1,5 / 100 pasien-tahun).
Sebagian besar fraktur pada wanita yang menerima rosiglitazone dilaporkan pada lengan atas, tangan, dan kaki. [Lihat PERINGATAN DAN PENCEGAHAN.] Kejadian fraktur yang diamati untuk pasien pria adalah serupa di antara 3 kelompok perlakuan.
Tabel 5. Kejadian Buruk Saat Terapi (â ‰ ¥ 5 Kejadian / 100 Pasien-Tahun [PY]) dalam Kelompok Perawatan Apa Saja yang Dilaporkan dalam Uji Klinis selama 4-6 tahun dari AVANDIA sebagai Monoterapi (ADOPT)
| AVANDIA N = 1.456 PY = 4,954 |
Glyburide N = 1.441 PY = 4,244 |
Metformin N = 1.454 PY = 4.906 |
|
| Nasofaringitis | 6.3 | 6.9 | 6.6 |
| Sakit punggung | 5.1 | 4.9 | 5.3 |
| Arthralgia | 5.0 | 4.8 | 4.2 |
| Hipertensi | 4.4 | 6.0 | 6.1 |
| Infeksi saluran pernapasan atas | 4.3 | 5.0 | 4.7 |
| Hipoglikemia | 2.9 | 13.0 | 3.4 |
| Diare | 2.5 | 3.2 | 6.8 |
Pediatrik
Avandia telah dievaluasi keamanannya dalam uji coba tunggal terkontrol aktif pasien anak dengan diabetes tipe 2 di mana 99 dirawat dengan Avandia dan 101 diobati dengan metformin. Reaksi merugikan yang paling umum (> 10%) tanpa memperhatikan kausalitas untuk Avandia atau metformin adalah sakit kepala (17% berbanding 14%), mual (4% berbanding 11%), nasofaringitis (3% berbanding 12%), dan diare (1% berbanding 13%). Dalam penelitian ini, satu kasus ketoasidosis diabetik dilaporkan pada kelompok metformin. Selain itu, ada 3 pasien dalam kelompok rosiglitazone yang memiliki FPG ˆ¼300 mg / dL, 2+ ketonuria, dan peningkatan anion gap.
Kelainan Laboratorium
Hematologi
Penurunan rata-rata hemoglobin dan hematokrit terjadi dalam cara yang berhubungan dengan dosis pada pasien dewasa yang dirawat dengan Avandia (penurunan rata-rata dalam studi individu sebanyak 1,0 g / dL hemoglobin dan sebanyak 3,3% hematokrit). Perubahan terjadi terutama selama 3 bulan pertama setelah dimulainya terapi dengan Avandia atau setelah peningkatan dosis di Avandia. Waktu perjalanan dan besarnya penurunan adalah serupa pada pasien yang diobati dengan kombinasi Avandia dan agen hipoglikemik lainnya atau monoterapi dengan Avandia. Kadar hemoglobin dan hematokrit sebelum perawatan lebih rendah pada pasien dalam studi kombinasi metformin dan mungkin berkontribusi pada tingkat pelaporan anemia yang lebih tinggi. Dalam sebuah studi tunggal pada pasien anak, penurunan hemoglobin dan hematokrit (penurunan rata-rata 0,29 g / dL dan 0,95%, masing-masing) dilaporkan. Penurunan kecil dalam hemoglobin dan hematokrit juga telah dilaporkan pada pasien anak yang diobati dengan Avandia. Jumlah sel darah putih juga sedikit menurun pada pasien dewasa yang diobati dengan Avandia. Penurunan parameter hematologis mungkin terkait dengan peningkatan volume plasma yang diamati dengan pengobatan dengan Avandia.
Lemak
Perubahan lipid serum telah diamati setelah perawatan dengan Avandia pada orang dewasa [lihat Farmakologi Klinis ]. Perubahan kecil dalam parameter lipid serum dilaporkan pada anak-anak yang diobati dengan Avandia selama 24 minggu.
Tingkat Serum Transaminase
Dalam studi klinis pra-persetujuan pada 4.598 pasien yang diobati dengan Avandia (3.600 pasien-tahun pajanan) dan dalam jangka panjang 4- hingga 6 tahun penelitian pada 1.456 pasien yang diobati dengan Avandia (4.954 pasien-tahun paparan), tidak ada bukti yang diinduksi oleh obat hepatotoksisitas.
Dalam uji coba terkontrol pra-persetujuan, 0,2% pasien yang diobati dengan Avandia memiliki peningkatan ALT> 3X batas atas normal dibandingkan dengan 0,2% pada plasebo dan 0,5% pada pembanding aktif. Peningkatan ALT pada pasien yang diobati dengan Avandia adalah reversibel. Hiperbilirubinemia ditemukan pada 0,3% pasien yang diobati dengan Avandia dibandingkan dengan 0,9% yang diobati dengan plasebo dan 1% pada pasien yang diobati dengan pembanding aktif. Dalam uji klinis pra-persetujuan, tidak ada kasus reaksi obat idiosinkratik yang menyebabkan kegagalan hati. [Lihat Peringatan dan pencegahan]
Dalam uji coba ADOPT 4 hingga 6 tahun, pasien yang diobati dengan Avandia (4.954 pasien-tahun paparan), glybide (4.244 pasien-tahun paparan), atau metformin (pajanan 4.906 pasien-tahun), sebagai monoterapi, memiliki tingkat peningkatan ALT yang sama hingga> 3X batas atas normal (0,3 per 100 pasien-tahun). paparan).
Pengalaman Postmarketing
Selain reaksi merugikan yang dilaporkan dari uji klinis, peristiwa yang dijelaskan di bawah ini telah diidentifikasi selama penggunaan Avandia pasca persetujuan. Karena kejadian ini dilaporkan secara sukarela dari populasi dengan ukuran yang tidak diketahui, tidak mungkin untuk memperkirakan frekuensi mereka dengan andal atau untuk selalu membangun hubungan sebab akibat dengan paparan obat.
Pada pasien yang menerima terapi tiazolidinedione, efek samping serius dengan atau tanpa hasil yang fatal, berpotensi terkait dengan ekspansi volume (mis., gagal jantung kongestif, edema paru, dan efusi pleura) telah dilaporkan [Lihat Peringatan Kotak dan Peringatan dan pencegahan].
Ada laporan postmarketing dengan Avandia tentang hepatitis, peningkatan enzim hati hingga 3 kali atau lebih batas atas kegagalan normal, dan hati dengan dan tanpa hasil fatal, meskipun kausalitas belum mapan.
Ruam, pruritus, urtikaria, angioedema, reaksi anafilaksis, dan sindrom Stevens-Johnson telah dilaporkan jarang terjadi.
Laporan onset baru atau edema makula diabetik yang memburuk dengan penurunan ketajaman visual juga telah diterima [lihat Peringatan dan pencegahan].
teratas
Interaksi obat
Inhibitor dan Induser CYP2C8
Inhibitor CYP2C8 (mis., Gemfibrozil) dapat meningkatkan AUC rosiglitazone dan induser CYP2C8 (mis., Rifampisin) dapat menurunkan AUC rosiglitazone. Oleh karena itu, jika inhibitor atau induser CYP2C8 dimulai atau dihentikan selama pengobatan dengan rosiglitazone, perubahan dalam pengobatan diabetes mungkin diperlukan berdasarkan respon klinis. [Lihat FARMAKOLOGI KLINIS.]
teratas
Gunakan dalam Populasi Tertentu
Kehamilan
Kategori Kehamilan C.
Semua kehamilan memiliki latar belakang risiko cacat lahir, kehilangan, atau hasil buruk lainnya terlepas dari paparan obat. Risiko latar belakang ini meningkat pada kehamilan yang dipersulit oleh hiperglikemia dan dapat dikurangi dengan kontrol metabolik yang baik. Sangat penting bagi pasien dengan diabetes atau riwayat diabetes gestasional untuk mempertahankan kontrol metabolisme yang baik sebelum konsepsi dan selama kehamilan. Pemantauan kontrol glukosa yang cermat sangat penting pada pasien tersebut. Kebanyakan ahli merekomendasikan bahwa monoterapi insulin digunakan selama kehamilan untuk menjaga kadar glukosa darah sedekat mungkin.
Data Manusia: Rosiglitazone telah dilaporkan melintasi plasenta manusia dan dapat terdeteksi pada jaringan janin. Signifikansi klinis dari temuan ini tidak diketahui. Tidak ada studi yang memadai dan terkontrol dengan baik pada wanita hamil. AVANDIA tidak boleh digunakan selama kehamilan.
Studi Hewan: Tidak ada efek pada implantasi atau embrio dengan pengobatan rosiglitazone selama awal kehamilan pada tikus, tetapi pengobatan selama pertengahan pertengahan kehamilan dikaitkan dengan kematian janin dan retardasi pertumbuhan pada tikus dan kelinci. Teratogenisitas tidak diamati pada dosis hingga 3 mg / kg pada tikus dan 100 mg / kg pada kelinci (sekitar 20 dan 75 kali AUC manusia pada dosis harian maksimum yang direkomendasikan masing-masing). Rosiglitazone menyebabkan patologi plasenta pada tikus (3 mg / kg / hari). Pengobatan tikus selama kehamilan melalui menyusui mengurangi ukuran serasah, viabilitas neonatal, dan pertumbuhan postnatal, dengan retardasi pertumbuhan yang dapat dibalik setelah pubertas. Untuk efek pada plasenta, embrio / janin, dan keturunan, dosis tanpa efek adalah 0,2 mg / kg / hari pada tikus dan 15 mg / kg / hari pada kelinci. Level tanpa efek ini kira-kira 4 kali AUC manusia pada dosis harian maksimum yang direkomendasikan manusia. Rosiglitazone mengurangi jumlah implantasi uterus dan keturunan hidup ketika tikus betina muda dirawat di usia 40 tahun. mg / kg / hari dari usia 27 hari hingga kematangan seksual (sekitar 68 kali AUC manusia pada maksimum yang direkomendasikan setiap hari dosis). Tingkat tanpa efek adalah 2 mg / kg / hari (sekitar 4 kali AUC manusia pada dosis harian maksimum yang disarankan). Tidak ada efek pada kelangsungan hidup atau pertumbuhan sebelum atau sesudah kelahiran.
Persalinan dan melahirkan
Efek rosiglitazone pada persalinan dan pengiriman pada manusia tidak diketahui.
Menyusui Ibu
Bahan terkait obat terdeteksi dalam susu dari tikus menyusui. Tidak diketahui apakah AVANDIA diekskresikan dalam ASI. Karena banyak obat diekskresikan dalam ASI, AVANDIA tidak boleh diberikan kepada wanita menyusui.
Penggunaan Pediatrik
Setelah plasebo termasuk konseling diet, anak-anak dengan diabetes mellitus tipe 2, berusia 10 hingga 17 tahun dan dengan indeks massa tubuh rata-rata (IMT) dasar 33 kg / m, diacak untuk pengobatan dengan AVANDIA 2 mg dua kali sehari (n = 99) atau 500 mg dua kali sehari metformin (n = 101) dalam 24 minggu, klinis double-blind percobaan. Seperti yang diharapkan, FPG menurun pada pasien yang belum minum obat diabetes (n = 104) dan meningkat pada pasien yang ditarik dari pengobatan sebelumnya (biasanya metformin) (n = 90) selama periode berjalan. Setelah setidaknya 8 minggu pengobatan, 49% pasien yang diobati dengan AVANDIA dan 55% pasien yang diobati dengan metformin memiliki dosis dua kali lipat jika FPG> 126 mg / dL. Untuk keseluruhan populasi yang ingin diobati, pada minggu ke 24, perubahan rata-rata dari awal di HbA1c adalah -0,14% dengan AVANDIA dan -0,49% dengan metformin. Ada jumlah pasien yang tidak mencukupi dalam penelitian ini untuk menentukan secara statistik apakah ini
diamati efek pengobatan rata-rata adalah serupa atau berbeda. Efek pengobatan berbeda untuk pasien yang belum pernah terapi dengan obat antidiabetes dan untuk pasien yang sebelumnya diobati dengan terapi antidiabetes (Tabel 6).
Tabel 6. Minggu 24 FPG dan HbA1c Berubah Dari Baseline Terakhir-Pengamatan-Dilakukan ke Depan pada Anak-anak Dengan HbA1c Baseline> 6,5%
| Pasien yang naif | Pasien yang sebelumnya dirawat | |||
|
Metformin N = 40 |
Rosiglitazone N = 45 |
Metformin N = 43 |
Rosiglitazone N = 32 |
|
| FPG (mg / dL) | ||||
| Baseline (rata-rata) | 170 | 165 | 221 | 205 |
| Ubah dari garis dasar (rata-rata) | -21 | -11 | -33 | -5 |
| Perbedaan pengobatan yang disesuaikan * (rosiglitazone-metformin) â € (95% CI) | 8 (-15, 30) |
21 (-9, 51) |
||
| % pasien dengan â ‰ ¥ 30 mg / dL menurun dari awal | 43% | 27% | 44% | 28% |
| HbA1c (%) | ||||
| Baseline (rata-rata) | 8.3 | 8.2 | 8.8 | 8.5 |
| Ubah dari garis dasar (rata-rata) | -0.7 | -0.5 | -0.4 | 0.1 |
| Perbedaan pengobatan yang disesuaikan * (rosiglitazone-metformin) â € (95% CI) | 0.2 (-0.6, 0.9) |
0.5 (-0.2, 1.3) |
||
| % pasien dengan â ‰ ¥ penurunan 0,7% dari awal | 63% | 52% | 54% | 31% |
|
* Perubahan dari rata-rata awal adalah kuadrat terkecil artinya menyesuaikan untuk HbA1c dasar, jenis kelamin, dan wilayah. †Nilai-nilai positif untuk perbedaan mendukung metformin. |
Perbedaan pengobatan tergantung pada IMT awal atau berat badan sehingga efek AVANDIA dan metformin tampak lebih sebanding di antara pasien yang lebih berat. Pertambahan berat rata-rata adalah 2,8 kg dengan rosiglitazone dan 0,2 kg dengan metformin [lihat PERINGATAN DAN PENCEGAHAN]. Lima puluh empat persen pasien yang diobati dengan rosiglitazone dan 32% pasien yang diobati dengan metformin memperoleh â ‰ ¥ 2 kg, dan 33% pasien yang diobati dengan rosiglitazone dan 7% pasien yang diobati dengan metformin memperoleh â ‰ ¥ 5 kg pada belajar.
Kejadian buruk yang diamati dalam penelitian ini dijelaskan dalam Reaksi yang Buruk).
Gambar 3. Berarti HbA1c Seiring Waktu dalam Studi 24-minggu AVANDIA dan Metformin pada Pasien Pediatrik - Subkelompok Obat-Naïve

Penggunaan Geriatri
Hasil analisis farmakokinetik populasi menunjukkan bahwa usia tidak secara signifikan mempengaruhi farmakokinetik rosiglitazone [lihat FARMAKOLOGI KLINIS]. Oleh karena itu, penyesuaian dosis tidak diperlukan untuk lansia. Dalam uji klinis terkontrol, tidak ada perbedaan keseluruhan dalam keamanan dan efektivitas antara pasien yang lebih tua (â ‰ ¥ 65 tahun) dan lebih muda (<65 tahun) diamati.
teratas
Overdosis
Data terbatas tersedia sehubungan dengan overdosis pada manusia. Dalam studi klinis pada sukarelawan, AVANDIA telah diberikan pada dosis oral tunggal hingga 20 mg dan dapat ditoleransi dengan baik. Jika terjadi overdosis, pengobatan suportif yang sesuai harus dimulai sebagaimana ditentukan oleh status klinis pasien.
teratas
Deskripsi
AVANDIA (rosiglitazone maleate) adalah agen antidiabetik oral yang bertindak terutama dengan meningkatkan sensitivitas insulin. AVANDIA meningkatkan kontrol glikemik sekaligus mengurangi kadar insulin yang bersirkulasi.
Rosiglitazone maleate tidak secara kimia atau fungsional terkait dengan sulfonilurea, biguanida, atau inhibitor alpha-glukosidase.
Secara kimia, rosiglitazone maleat adalah (±) -5 - [[4- [2- (metil-2-piridinilamino) etoksi] fenil] metil] -2,4-thiazolidinedione, (Z) -2-butenedioate (1: 1) dengan berat molekul 473,52 (357,44 basis gratis). Molekul memiliki pusat kiral tunggal dan hadir sebagai rasemat. Karena interkonversi yang cepat, enansiomer secara fungsional tidak dapat dibedakan. Formula struktural rosiglitazone maleate adalah:
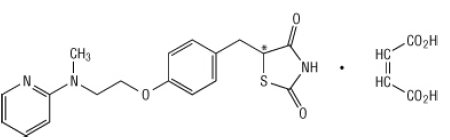
Rumus molekul adalah C18H19N3O3S-C4H4O4. Maleat Rosiglitazone adalah padatan putih ke putih dengan kisaran titik leleh 122 hingga 123 ° C. Nilai pKa rosiglitazone maleate adalah 6,8 dan 6,1. Ini mudah larut dalam etanol dan a larutan berair buffered dengan pH 2,3; kelarutan berkurang dengan meningkatnya pH secara fisiologis jarak.
Setiap tablet TILTAB berlapis film pentagonal mengandung rosiglitazone maleate setara dengan rosiglitazone, 2 mg, 4 mg, atau 8 mg, untuk pemberian oral. Bahan aktif adalah: Hypromellose 2910, lactose monohydrate, magnesium stearate, selulosa mikrokristalin, polietilen glikol 3000, natrium pati glikolat, titanium dioksida, triasetin, dan 1 atau lebih dari yang berikut ini: oksida besi merah dan kuning sintetis dan talek.
teratas
Farmakologi Klinis
Mekanisme aksi
Rosiglitazone, anggota kelas agen antidiabetik thiazolidinedione, meningkatkan kontrol glikemik dengan meningkatkan sensitivitas insulin. Rosiglitazone adalah agonis yang sangat selektif dan kuat untuk peroxisome proliferator-activated receptor-gamma (PPARγ). Pada manusia, reseptor PPAR ditemukan di jaringan target utama untuk aksi insulin seperti jaringan adiposa, otot rangka, dan hati. Aktivasi reseptor nuklir PPARγ mengatur transkripsi gen yang responsif insulin yang terlibat dalam kontrol produksi glukosa, transportasi, dan pemanfaatan. Selain itu, gen yang responsif PPARγ juga berpartisipasi dalam regulasi metabolisme asam lemak.
Resistensi insulin adalah fitur umum yang menjadi ciri patogenesis diabetes tipe 2. Aktivitas antidiabetes rosiglitazone telah ditunjukkan dalam model hewan diabetes tipe 2 di Indonesia yang hiperglikemia dan / atau gangguan toleransi glukosa merupakan konsekuensi dari resistensi insulin pada target tisu. Rosiglitazone mengurangi konsentrasi glukosa darah dan mengurangi hiperinsulinemia pada tikus ob / ob obese, tikus diabetes db / db, dan tikus lemak Zucker lemak.
Pada model hewan, aktivitas antidiabetik rosiglitazone terbukti dimediasi oleh peningkatan sensitivitas terhadap aksi insulin di hati, otot, dan jaringan adiposa. Studi farmakologis pada model hewan menunjukkan bahwa rosiglitazone menghambat glukoneogenesis hati. Ekspresi transporter glukosa yang diatur insulin GLUT-4 meningkat pada jaringan adiposa. Rosiglitazone tidak menyebabkan hipoglikemia pada hewan model diabetes tipe 2 dan / atau gangguan toleransi glukosa.
Farmakodinamik
Pasien dengan kelainan lipid tidak dikeluarkan dari uji klinis AVANDIA.
Dalam semua uji coba terkontrol 26 minggu, di seluruh rentang dosis yang direkomendasikan, AVANDIA sebagai monoterapi dikaitkan dengan peningkatan kolesterol total, LDL, dan HDL dan penurunan asam lemak bebas. Perubahan-perubahan ini secara statistik berbeda secara signifikan dari kontrol plasebo atau glyburide (Tabel 7).
Peningkatan LDL terjadi terutama selama 1 hingga 2 bulan pertama terapi dengan tingkat AVANDIA dan LDL tetap meningkat di atas garis dasar selama uji coba. Sebaliknya, HDL terus meningkat dari waktu ke waktu. Akibatnya, rasio LDL / HDL memuncak setelah 2 bulan terapi dan kemudian tampak menurun dari waktu ke waktu. Karena sifat temporal dari perubahan lipid, studi terkontrol glyburide 52 minggu paling relevan untuk menilai efek jangka panjang pada lipid. Pada awal, minggu 26, dan minggu 52, rasio LDL / HDL rata-rata adalah 3,1, 3,2, dan 3,0, masing-masing, untuk AVANDIA 4 mg dua kali sehari. Nilai yang sesuai untuk glyburide adalah 3.2, 3.1, dan 2.9. Perbedaan dalam perubahan dari awal antara AVANDIA dan glyburide pada minggu ke 52 adalah signifikan secara statistik.
Pola perubahan LDL dan HDL setelah terapi dengan AVANDIA dalam kombinasi dengan agen hipoglikemik lainnya umumnya serupa dengan yang terlihat dengan AVANDIA dalam monoterapi.
Perubahan trigliserida selama terapi dengan AVANDIA adalah variabel dan umumnya tidak berbeda secara statistik dari kontrol plasebo atau glybide.
Tabel 7. Ringkasan Perubahan Lipid Rata-Rata dalam Studi Monoterapi Terkontrol-Terkontrol-Plasebo dan -Minggu-52-Minggu
| Studi Terkontrol Placebo Minggu 26 | Minggu Studi Glyburide-Controlled 26 dan Minggu 52 | ||||||
| Placebo | AVANDIA | Titrasi Glyburide | AVANDIA 8 mg | ||||
| 4 mg setiap hari * | 8 mg setiap hari * | Minggu 26 | Minggu 52 | Minggu 26 | Minggu 52 | ||
| Asam lemak gratis | |||||||
| N | 207 | 428 | 436 | 181 | 168 | 166 | 145 |
| Baseline (rata-rata)% | 18.1 | 17.5 | 17.9 | 26.4 | 26.4 | 26.9 | 26.6 |
| Ubah dari garis dasar (rata-rata) | +0.2% | -7.8% | -14.7% | -2.4% | -4.7% | -20.8% | -21.5% |
| LDL | |||||||
| N | 190 | 400 | 374 | 175 | 160 | 161 | 133 |
| Baseline (rata-rata)% | 123.7 | 126.8 | 125.3 | 142.7 | 141.9 | 142.1 | 142.1 |
| Ubah dari garis dasar (rata-rata) | +4.8% | +14.1% | +18.6% | -0.9% | -0.5% | +11.9% | +12.1% |
| HDL | |||||||
| N | 208 | 429 | 436 | 184 | 170 | 170 | 145 |
| Baseline (rata-rata)% | 44.1 | 44.4 | 43.0 | 47.2 | 47.7 | 48.4 | 48.3 |
| Ubah dari garis dasar (rata-rata) | +8.0% | +11.4% | +14.2% | +4.3% | +8.7% | +14.0% | +18.5% |
| * Kelompok dosis sekali sehari dan dua kali sehari digabungkan. |
Farmakokinetik
Konsentrasi plasma maksimum (Cmax) dan area di bawah kurva (AUC) rosiglitazone meningkat secara proporsional dengan dosis pada kisaran dosis terapeutik (Tabel 8). Waktu paruh eliminasi adalah 3 hingga 4 jam dan tidak tergantung dosis.
Tabel 8. Parameter Farmakokinetik Mean (SD) untuk Rosiglitazone Mengikuti Dosis Oral Tunggal (N = 32)
| Parameter | 1 mg Puasa | 2 mg Puasa | 8 mg Puasa | 8 mg Fed |
| AUC0-inf [ng-jam / mL] |
358 (112) |
733 (184) |
2,971 (730) |
2,890 (795) |
| Cmax [ng / mL] |
76 (13) |
156 (42) |
598 (117) |
432 (92) |
| Setengah hidup [jam] |
3.16 (0.72) |
3.15 (0.39) |
3.37 (0.63) |
3.59 (0.70) |
| CL / F * [L / jam] |
3.03 (0.87) |
2.89 (0.71) |
2.85 (0.69) |
2.97 (0.81) |
| * CL / F = Pembersihan oral. |
Penyerapan
Ketersediaan hayati absolut rosiglitazone adalah 99%. Konsentrasi plasma puncak diamati sekitar 1 jam setelah pemberian dosis. Pemberian rosiglitazone dengan makanan menghasilkan tidak ada perubahan pada paparan keseluruhan (AUC), tetapi ada sekitar 28% penurunan Cmax dan keterlambatan Tmax (1,75 jam). Perubahan ini kemungkinan tidak signifikan secara klinis; oleh karena itu, AVANDIA dapat diberikan dengan atau tanpa makanan.
Distribusi
Rata-rata (CV%) volume oral distribusi (Vss / F) rosiglitazone adalah sekitar 17,6 (30%) liter, berdasarkan pada analisis farmakokinetik populasi. Rosiglitazone sekitar 99,8% terikat dengan protein plasma, terutama albumin.
Metabolisme
Rosiglitazone dimetabolisme secara ekstensif tanpa obat yang tidak berubah diekskresikan dalam urin. Rute utama metabolisme adalah N-demetilasi dan hidroksilasi, diikuti oleh konjugasi dengan sulfat dan asam glukuronat. Semua metabolit yang bersirkulasi jauh lebih kuat daripada orang tua dan, oleh karena itu, tidak diharapkan berkontribusi pada aktivitas rosiglitazone yang peka terhadap insulin.
Data in vitro menunjukkan bahwa rosiglitazone sebagian besar dimetabolisme oleh Cytochrome P450 (CYP) isoenzyme 2C8, dengan CYP2C9 berkontribusi sebagai jalur minor.
Pengeluaran
Setelah pemberian rosiglitazone maleat [14C] oral atau intravena, masing-masing sekitar 64% dan 23% dosis dihilangkan dalam urin dan dalam feses. Waktu paruh plasma materi terkait [14C] berkisar antara 103 hingga 158 jam.
Farmakokinetik Populasi pada Pasien Dengan Diabetes Tipe 2
Analisis farmakokinetik populasi dari 3 uji klinis besar termasuk 642 pria dan 405 wanita dengan diabetes tipe 2 (usia 35 hingga 80 tahun) menunjukkan bahwa farmakokinetik rosiglitazone tidak dipengaruhi oleh usia, ras, merokok, atau alkohol konsumsi. Baik klirens oral (CL / F) dan volume distribusi steady-state oral (Vss / F) terbukti meningkat dengan meningkatnya berat badan. Selama rentang berat yang diamati dalam analisis ini (50 hingga 150 kg), kisaran nilai CL / F dan Vss / F yang diprediksi masing-masing bervariasi masing-masing <1,7 kali lipat dan <2,3 kali lipat.
Selain itu, rosiglitazone CL / F terbukti dipengaruhi oleh berat dan jenis kelamin, lebih rendah (sekitar 15%) pada pasien wanita.
Populasi Khusus
Geriatrik
Hasil analisis farmakokinetik populasi (n = 716 <65 tahun; n = 331 â ‰ ¥ 65 tahun) menunjukkan bahwa usia tidak secara signifikan mempengaruhi farmakokinetik rosiglitazone.
Jenis kelamin
Hasil analisis farmakokinetik populasi menunjukkan bahwa rerata oral rosiglitazone di Indonesia pasien wanita (n = 405) sekitar 6% lebih rendah dibandingkan dengan pasien pria dengan berat badan yang sama (n = 642).
Sebagai monoterapi dan dalam kombinasi dengan metformin, AVANDIA meningkatkan kontrol glikemik pada pria dan wanita. Dalam studi kombinasi metformin, kemanjuran ditunjukkan tanpa perbedaan gender dalam respons glikemik.
Dalam studi monoterapi, respon terapeutik yang lebih besar diamati pada wanita; Namun, pada pasien yang lebih gemuk, perbedaan jenis kelamin kurang jelas. Untuk indeks massa tubuh (BMI) yang diberikan, wanita cenderung memiliki massa lemak yang lebih besar daripada pria. Karena target molekul PPARγ diekspresikan dalam jaringan adiposa, karakteristik pembeda ini dapat menjelaskan, setidaknya sebagian, untuk respon yang lebih besar terhadap AVANDIA pada wanita. Karena terapi harus individual, tidak diperlukan penyesuaian dosis berdasarkan jenis kelamin saja.
Ggn hati
Klirens oral rosiglitazone yang tidak terikat secara signifikan lebih rendah pada pasien dengan penyakit hati sedang sampai berat (Child-Pugh Kelas B / C) dibandingkan dengan subyek sehat. Akibatnya, Cmax dan AUC0-inf yang tidak terikat masing-masing meningkat 2- dan 3 kali lipat. Waktu paruh eliminasi untuk rosiglitazone adalah sekitar 2 jam lebih lama pada pasien dengan penyakit hati, dibandingkan dengan subyek sehat.
Terapi dengan AVANDIA tidak boleh dimulai jika pasien menunjukkan bukti klinis aktif penyakit hati atau peningkatan kadar transaminase serum (ALT> 2.5X batas atas normal) pada awal [Lihat PERINGATAN DAN PENCEGAHAN].
Pediatrik
Parameter farmakokinetik rosiglitazone pada pasien anak ditetapkan dengan menggunakan analisis farmakokinetik populasi dengan data jarang dari 96 pasien pediatrik dalam uji klinis pediatrik tunggal termasuk 33 pria dan 63 wanita dengan usia mulai dari 10 hingga 17 tahun (berat mulai dari 35 hingga 178,3 kg). Populasi rata-rata CL / F dan V / F rosiglitazone masing-masing adalah 3,15 L / jam dan 13,5 L. Estimasi CL / F dan V / F ini konsisten dengan estimasi parameter tipikal dari analisis populasi dewasa sebelumnya.
Gangguan ginjal
Tidak ada perbedaan klinis yang relevan dalam farmakokinetik rosiglitazone pada pasien dengan ringan untuk gangguan ginjal berat atau pada pasien yang tergantung hemodialisis dibandingkan dengan subyek dengan ginjal normal fungsi. Karena itu tidak diperlukan penyesuaian dosis pada pasien yang menerima AVANDIA. Karena metformin dikontraindikasikan pada pasien dengan gangguan ginjal, pemberian metformin bersama AVANDIA dikontraindikasikan pada pasien ini.
Ras
Hasil analisis farmakokinetik populasi termasuk subjek Kaukasia, kulit hitam, dan asal etnis lainnya menunjukkan bahwa ras tidak memiliki pengaruh pada farmakokinetik rosiglitazone.
Interaksi Obat-Obat
Obat yang Menghambat, Menginduksi, atau Dimetabolisme oleh Sitokrom P450
Studi metabolisme obat in vitro menunjukkan bahwa rosiglitazone tidak menghambat salah satu enzim P450 utama pada konsentrasi yang relevan secara klinis. Data in vitro menunjukkan bahwa rosiglitazone sebagian besar dimetabolisme oleh CYP2C8, dan pada tingkat lebih rendah, 2C9. AVANDIA (4 mg dua kali sehari) terbukti tidak memiliki efek yang relevan secara klinis pada farmakokinetik nifedipine dan kontrasepsi oral (etinil estradiol dan norethindrone), yang sebagian besar dimetabolisme oleh CYP3A4.
Gemfibrozil
Pemberian gemfibrozil secara bersamaan (600 mg dua kali sehari), inhibitor CYP2C8, dan rosiglitazone (4 mg sekali setiap hari) selama 7 hari peningkatan AUC rosiglitazone sebesar 127%, dibandingkan dengan pemberian rosiglitazone (4 mg sekali sehari) sendirian. Mengingat potensi efek samping terkait dosis dengan rosiglitazone, penurunan dosis rosiglitazone mungkin diperlukan ketika gemfibrozil diperkenalkan [lihat INTERAKSI OBAT].
Rifampin
Pemberian rifampin (600 mg sekali sehari), penginduksi CYP2C8, selama 6 hari dilaporkan menurunkan AIG rosiglitazone sebesar 66%, dibandingkan dengan pemberian rosiglitazone (8 mg) saja [lihat INTERAKSI OBAT].4
Glyburide
AVANDIA (2 mg dua kali sehari) yang dikonsumsi bersamaan dengan glyburide (3,75 hingga 10 mg / hari) selama 7 hari tidak mengubah rata-rata konsentrasi glukosa plasma 24-jam tunak pada pasien diabetes stabil pada glyburide terapi. Dosis berulang dari AVANDIA (8 mg sekali sehari) selama 8 hari pada orang dewasa Kaukasia yang sehat menyebabkan penurunan AUC dan Cmax glyburide sekitar 30%. Dalam mata pelajaran Jepang, glyburide AUC dan Cmax sedikit meningkat setelah pemberian AVANDIA.
Glimepiride
Dosis oral tunggal glimepiride pada 14 subjek dewasa yang sehat tidak memiliki efek klinis yang signifikan terhadap farmakokinetik mapan AVANDIA. Tidak ada pengurangan signifikan secara klinis pada AUC dan C glimepiridemaks diamati setelah dosis berulang AVANDIA (8 mg sekali sehari) selama 8 hari pada subyek dewasa yang sehat.
Metformin
Pemberian AVANDIA bersamaan (2 mg dua kali sehari) dan metformin (500 mg dua kali sehari) dalam keadaan sehat sukarelawan selama 4 hari tidak memiliki efek pada farmakokinetik mapan dari metformin atau rosiglitazone.
Acarbose
Pemberian bersama acarbose (100 mg tiga kali sehari) selama 7 hari pada sukarelawan sehat tidak memiliki efek yang relevan secara klinis pada farmakokinetik dari dosis oral tunggal AVANDIA.
Digoxin
Pengulangan dosis AVANDIA oral (8 mg sekali sehari) selama 14 hari tidak mengubah farmakokinetik steady-state dari digoxin (0,375 mg sekali sehari) pada sukarelawan sehat.
Warfarin
Dosis ulangan dengan AVANDIA tidak memiliki efek yang relevan secara klinis pada farmakokinetik mapan enantiomer warfarin.
Etanol
Pemberian tunggal alkohol dalam jumlah sedang tidak meningkatkan risiko hipoglikemia akut pada pasien diabetes mellitus tipe 2 yang diobati dengan AVANDIA.
Ranitidine
Pretreatment dengan ranitidine (150 mg dua kali sehari selama 4 hari) tidak mengubah farmakokinetik dosis oral tunggal atau intravena rosiglitazone pada sukarelawan sehat.
Hasil ini menunjukkan bahwa penyerapan rosiglitazone oral tidak berubah dalam kondisi disertai dengan peningkatan pH gastrointestinal.
teratas
Toksikologi Nonklinis
Karsinogenesis, Mutagenesis, Penurunan Kesuburan
Karsinogenesis:
Studi 2 tahun karsinogenisitas dilakukan pada tikus Charles-1 CD-1 dengan dosis 0,4, 1,5, dan 6 mg / kg / hari dalam diet (dosis tertinggi setara dengan sekitar 12 kali AUC manusia pada maksimum yang direkomendasikan manusia setiap hari dosis). Tikus Sprague-Dawley diberi dosis selama 2 tahun dengan oral oral pada dosis 0,05, 0,3, dan 2 mg / kg / hari (setara dosis tertinggi untuk sekitar 10 dan 20 kali AUC manusia pada dosis harian maksimum yang direkomendasikan manusia untuk tikus jantan dan betina, masing-masing).
Rosiglitazone tidak bersifat karsinogenik pada tikus. Ada peningkatan kejadian hiperplasia adiposa pada tikus dengan dosis 1,5 mg / kg / hari (sekitar 2 kali AUC manusia pada dosis harian maksimum yang direkomendasikan manusia). Pada tikus, ada peningkatan yang signifikan dalam kejadian tumor jaringan adiposa jinak (lipoma) pada dosis 0,3 mg / kg / hari (sekitar 2 kali AUC manusia pada dosis harian maksimum yang direkomendasikan manusia). Perubahan proliferatif pada kedua spesies ini dianggap karena farmakologis berlebihan jaringan adiposa yang persisten.
Mutagenesis:
Rosiglitazone tidak bersifat mutagenik atau klastogenik dalam uji bakteri in vitro untuk mutasi gen, in vitro uji aberasi kromosom pada limfosit manusia, uji mikronukleus tikus in vivo, dan tikus UDS in vivo / in vitro pengujian kadar logam. Ada peningkatan kecil (sekitar 2 kali lipat) dalam mutasi dalam uji limfoma tikus in vitro di hadapan aktivasi metabolik.
Penurunan Kesuburan:
Rosiglitazone tidak memiliki efek pada perkawinan atau kesuburan tikus jantan yang diberikan hingga 40 mg / kg / hari (sekitar 116 kali AUC manusia pada dosis harian maksimum yang direkomendasikan manusia). Rosiglitazone mengubah siklis ester (2 mg / kg / hari) dan mengurangi kesuburan (40 mg / kg / hari) tikus betina terkait dengan yang lebih rendah kadar progesteron dan estradiol plasma (sekitar 20 dan 200 kali AUC manusia pada dosis harian maksimum yang direkomendasikan manusia, masing-masing). Tidak ada efek yang tercatat pada 0,2 mg / kg / hari (sekitar 3 kali AUC manusia pada dosis harian maksimum yang direkomendasikan manusia). Pada tikus muda yang diberi dosis mulai dari 27 hari hingga kematangan seksual (hingga 40 mg / kg / hari), tidak ada efek pada kinerja reproduksi pria, atau pada siklus estrus, kinerja perkawinan atau kejadian kehamilan pada wanita (sekitar 68 kali AUC manusia pada manusia maksimum yang direkomendasikan setiap hari) dosis). Pada monyet, rosiglitazone (0,6 dan 4,6 mg / kg / hari; sekitar 3 dan 15 kali AUC manusia pada dosis harian maksimum yang direkomendasikan, masing-masing) mengurangi kenaikan fase folikuler dalam serum estradiol dengan pengurangan konsekuensi dalam lonjakan hormon luteinisasi, kadar progesteron fase luteal yang lebih rendah, dan amenorea Mekanisme untuk efek ini tampaknya menjadi penghambatan langsung steroidogenesis ovarium.
Toksikologi Hewan
Bobot jantung meningkat pada tikus (3 mg / kg / hari), tikus (5 mg / kg / hari), dan anjing (2 mg / kg / hari) dengan rosiglitazone perawatan (sekitar 5, 22, dan 2 kali AUC manusia pada dosis harian manusia maksimum yang disarankan, masing-masing). Efek pada tikus muda konsisten dengan yang terlihat pada orang dewasa. Pengukuran morfometrik menunjukkan bahwa ada hipertrofi pada jaringan ventrikel jantung, yang mungkin disebabkan oleh peningkatan kerja jantung sebagai akibat dari ekspansi volume plasma.
teratas
Studi Klinis
Monoterapi
Dalam studi klinis, pengobatan dengan AVANDIA menghasilkan peningkatan kontrol glikemik, yang diukur dengan FPG dan HbA1c, dengan pengurangan bersamaan insulin dan C-peptida. Glukosa dan insulin postprandial juga berkurang. Ini konsisten dengan mekanisme kerja AVANDIA sebagai sensitizer insulin.
Dosis harian maksimum yang disarankan adalah 8 mg. Studi rentang dosis menunjukkan bahwa tidak ada manfaat tambahan yang diperoleh dengan dosis harian total 12 mg.
Studi Klinis Jangka Pendek: Sebanyak 2.315 pasien dengan diabetes tipe 2, yang sebelumnya diobati dengan diet saja atau obat antidiabetik, diobati dengan AVANDIA sebagai monoterapi dalam 6 double-blind penelitian, yang meliputi dua studi terkontrol plasebo 26 minggu, satu studi terkontrol glybid 52 minggu, dan 3 studi rentang dosis terkontrol plasebo dengan durasi 8 hingga 12 minggu. Obat antidiabetes sebelumnya telah ditarik dan pasien memasuki periode plasebo 2 hingga 4 minggu sebelum pengacakan.
Dua 26 minggu, double-blind, uji coba terkontrol plasebo, pada pasien dengan diabetes tipe 2 (n = 1.401) dengan glisemik yang tidak memadai kontrol (rata-rata FPG awal sekitar 228 mg / dL [101 hingga 425 mg / dL] dan rata-rata baseline HbA1c 8,9% [5,2% hingga 16,2%]), dilakukan. Pengobatan dengan AVANDIA menghasilkan peningkatan yang signifikan secara statistik pada FPG dan HbA1c dibandingkan dengan awal dan relatif terhadap plasebo. Data dari salah satu studi ini dirangkum dalam Tabel 9.
Tabel 9: Parameter Glikemik dalam Uji Coba Terkontrol Plasebo 26-Minggu
| Placebo N = 173 |
AVANDIA | AVANDIA | |||
| 4 mg sekali sehari N = 180 |
2 mg dua kali sehari N = 186 |
8 mg sekali sehari N = 181 |
4 mg dua kali sehari N = 187 |
||
| FPG (mg / dL) | |||||
| Baseline (rata-rata) | 225 | 229 | 225 | 228 | 228 |
| Ubah dari garis dasar (rata-rata) | 8 | -25 | -35 | -42 | -55 |
| Perbedaan dari plasebo (rata-rata yang disesuaikan) | - | -31* | -43* | -49* | -62* |
| % pasien dengan â ‰ ¥ 30 mg / dL menurun dari awal | 19% | 45% | 54% | 58% | 70% |
| HbA1c (%) | |||||
| Baseline (rata-rata) | 8.9 | 8.9 | 8.9 | 8.9 | 9.0 |
| Ubah dari garis dasar (rata-rata) | 0.8 | 0.0 | -0.1 | -0.3 | -0.7 |
| Perbedaan dari plasebo (rata-rata yang disesuaikan) | - | -0.8* | -0.9* | -1.1* | -1.5* |
| % pasien dengan â ‰ ¥ penurunan 0,7% dari awal | 9% | 28% | 29% | 39% | 54% |
| * p <0,0001 dibandingkan dengan plasebo. |
Ketika diberikan pada dosis harian total yang sama, AVANDIA umumnya lebih efektif dalam mengurangi FPG dan HbA1c ketika diberikan dalam dosis terbagi dua kali sehari dibandingkan dengan dosis sekali sehari. Namun, untuk HbA1c, perbedaan antara dosis 4 mg sekali sehari dan 2 mg dua kali sehari tidak signifikan secara statistik.
Studi Klinis Jangka Panjang
Pemeliharaan efek jangka panjang dievaluasi dalam percobaan 52 minggu, double-blind, glyburide-controlled pada pasien dengan diabetes tipe 2. Pasien diacak untuk pengobatan dengan AVANDIA 2 mg dua kali sehari (N = 195) atau AVANDIA 4 mg dua kali sehari (N = 189) atau glyburide (N = 202) selama 52 minggu. Pasien yang menerima glyburide diberi dosis awal 2,5 mg / hari atau 5,0 mg / hari. Dosis kemudian dititrasi dalam peningkatan 2,5 mg / hari selama 12 minggu ke depan, dengan dosis maksimum 15,0 mg / hari untuk mengoptimalkan kontrol glikemik. Setelah itu, dosis glyburide dijaga konstan.
Dosis rata-rata yang dititrasi dari glyburide adalah 7,5 mg. Semua perawatan menghasilkan peningkatan kontrol glikemik yang signifikan secara statistik dari awal (Gambar 4 dan Gambar 5). Pada akhir minggu 52, pengurangan dari baseline di FPG dan HbA1c adalah -40,8 mg / dL dan -0,53% dengan AVANDIA 4 mg dua kali sehari; -25,4 mg / dL dan -0,27% dengan AVANDIA 2 mg dua kali sehari; dan -30,0 mg / dL dan -0,72% dengan glyburide. Untuk HbA1c, perbedaan antara AVANDIA 4 mg dua kali sehari dan glyburide tidak signifikan secara statistik pada minggu ke 52. Penurunan awal dalam FPG dengan glburida lebih besar daripada dengan AVANDIA; Namun, efek ini kurang tahan lama.
Peningkatan kontrol glikemik yang terlihat dengan AVANDIA 4 mg dua kali sehari pada minggu 26 dipertahankan sampai minggu ke-52 penelitian.
Gambar 4. Berarti FPG Seiring Waktu dalam Studi Terkontrol Glyburide 52-Minggu

Gambar 5. Berarti HbA1c Seiring Waktu dalam Studi Terkontrol Glyburide 52-Minggu

Hipoglikemia dilaporkan pada 12,1% dari pasien yang diobati dengan glburide versus 0,5% (2 mg dua kali sehari) dan 1,6% (4 mg dua kali sehari) dari pasien yang diobati dengan AVANDIA. Peningkatan dalam kontrol glikemik dikaitkan dengan kenaikan berat badan rata-rata 1,75 kg dan 2,95 kg untuk pasien yang diobati dengan AVANDIA 2 mg dan 4 mg dua kali sehari, masing-masing, berbanding 1.9 kg yang diobati dengan glyburide pasien. Pada pasien yang diobati dengan AVANDIA, produk C-peptide, insulin, pro-insulin, dan pro-insulin split adalah berkurang secara signifikan dalam dosis yang dipesan, dibandingkan dengan peningkatan yang diobati dengan glyburide pasien.
Percobaan Perkembangan Hasil Diabetes (ADOPT) adalah uji coba multicenter, double-blind, terkontrol (N = 4,351) yang dilakukan selama 4 hingga 6 tahun untuk membandingkan keamanan dan kemanjuran. dari AVANDIA, metformin, dan monoterapi glyburide pada pasien yang baru didiagnosis dengan diabetes mellitus tipe 2 (â ‰ ¤ 3 tahun) tidak terkontrol dengan diet dan olahraga. Usia rata-rata pasien dalam percobaan ini adalah 57 tahun dan mayoritas pasien (83%) tidak memiliki riwayat penyakit kardiovaskular. Rata-rata baseline FPG dan HbA1c adalah 152 mg / dL dan 7,4%, masing-masing. Pasien secara acak menerima baik AVANDIA 4 mg sekali sehari, glyburide 2,5 mg sekali sehari, atau metformin 500 mg sekali sehari, dan dosisnya adalah dititrasi untuk kontrol glikemik yang optimal hingga maksimum 4 mg dua kali sehari untuk AVANDIA, 7,5 mg dua kali sehari untuk glikburida, dan 1.000 mg dua kali sehari untuk metformin. Hasil efikasi primer adalah waktu untuk FPG berturut-turut> 180 mg / dL setelah setidaknya 6 minggu pengobatan maksimal dosis obat studi yang ditoleransi atau waktu untuk kontrol glikemik yang tidak memadai, sebagaimana ditentukan oleh ajudikasi independen komite.
Insiden kumulatif dari hasil efikasi primer pada 5 tahun adalah 15% dengan AVANDIA, 21% dengan metformin, dan 34% dengan glyburide (rasio bahaya 0,68 [95% CI 0,55, 0,85] versus metformin, HR 0,37 [95% CI 0,30, 0,45] dibandingkan dengan glyburide).
Data kejadian kardiovaskular dan efek samping (termasuk efek pada berat badan dan patah tulang) dari ADOPT untuk AVANDIA, metformin, dan glyburide dijelaskan dalam PERINGATAN DAN PENCEGAHAN dan ADVERSE REACTIONSmasing-masing. Seperti halnya semua obat, hasil kemanjuran harus dipertimbangkan bersama dengan informasi keselamatan untuk menilai manfaat dan risiko potensial untuk masing-masing pasien.
Kombinasi dengan Metformin atau Sulfonylurea
Penambahan AVANDIA baik untuk metformin atau sulfonylurea menghasilkan pengurangan signifikan dalam hiperglikemia dibandingkan dengan salah satu dari agen ini saja. Hasil ini konsisten dengan efek tambahan pada kontrol glikemik ketika AVANDIA digunakan sebagai terapi kombinasi.
Kombinasi dengan Metformin
Sebanyak 670 pasien dengan diabetes tipe 2 berpartisipasi dalam dua 26 minggu, secara acak, double-blind, plasebo / studi terkontrol aktif yang dirancang untuk menilai kemanjuran AVANDIA dalam kombinasi dengan metformin. AVANDIA, diberikan dalam rejimen dosis sekali sehari atau dua kali sehari, ditambahkan ke terapi pasien yang tidak terkontrol dengan dosis maksimum (2,5 gram / hari) metformin.
Dalam satu studi, pasien tidak cukup terkontrol pada 2,5 gram / hari metformin (rerata FPG 216 mg / dL dan rerata awal HbA1c 8,8%) secara acak menerima 4 mg AVANDIA sekali sehari, 8 mg AVANDIA sekali sehari, atau plasebo sebagai tambahan metformin. Peningkatan signifikan secara statistik pada FPG dan HbA1c diamati pada pasien yang diobati dengan kombinasi metformin dan 4 mg AVANDIA sekali sehari dan 8 mg AVANDIA sekali sehari, dibandingkan pasien yang melanjutkan dengan metformin saja (Tabel 10).
Tabel 10. Parameter Glikemik dalam Studi Kombinasi 26-minggu dari AVANDIA Plus Metformin
| Metformin N = 113 |
AVANDIA 4 mg sekali sehari + metformin N = 116 |
AVANDIA 8 mg sekali sehari + metformin N = 110 |
|
| FPG (mg / dL) | |||
| Baseline (rata-rata) | 214 | 215 | 220 |
| Ubah dari garis dasar (rata-rata) | 6 | -33 | -48 |
| Perbedaan dari metformin saja (berarti disesuaikan) | - | -40* | -53* |
| % pasien dengan â ‰ ¥ 30 mg / dL menurun dari awal | 20% | 45% | 61% |
| HbA1c (%) | |||
| Baseline (rata-rata) | 8.6 | 8.9 | 8.9 |
| Ubah dari garis dasar (rata-rata) | 0.5 | -0.6 | -0.8 |
| Perbedaan dari metformin saja (berarti disesuaikan) | - | -1.0* | -1.2* |
| % pasien dengan â ‰ ¥ penurunan 0,7% dari awal | 11% | 45% | 52% |
| * p <0,0001 dibandingkan dengan metformin. |
Dalam studi 26 minggu kedua, pasien dengan diabetes tipe 2 tidak cukup terkontrol pada 2,5 gram / hari metformin yang diacak untuk menerima kombinasi AVANDIA 4 mg dua kali sehari dan metformin (N = 105) menunjukkan peningkatan yang signifikan secara statistik dalam kontrol glikemik dengan efek pengobatan rata-rata untuk FPG -56 mg / dL dan efek pengobatan rata-rata untuk HbA1c -0,8% lebih metformin sendiri. Kombinasi metformin dan AVANDIA menghasilkan tingkat FPG dan HbA1c yang lebih rendah daripada masing-masing agen saja.
Pasien yang tidak terkontrol dengan dosis maksimum (2,5 gram / hari) metformin dan yang beralih ke monoterapi dengan AVANDIA menunjukkan hilangnya kontrol glikemik, sebagaimana dibuktikan oleh peningkatan FPG dan HbA1c. Dalam kelompok ini, peningkatan LDL dan VLDL juga terlihat.
Kombinasi dengan Sulfonylurea
Sebanyak 3.457 pasien dengan diabetes tipe 2 berpartisipasi dalam sepuluh 24 hingga 26 minggu studi acak, double-blind, plasebo / kontrol aktif dan satu Penelitian double-blind dua-tahun aktif-terkontrol pada pasien usia lanjut yang dirancang untuk menilai kemanjuran dan keamanan AVANDIA dalam kombinasi dengan sulfonilurea. AVANDIA 2 mg, 4 mg, atau 8 mg setiap hari diberikan, baik sekali sehari (3 studi) atau dalam dosis terbagi dua kali sehari (7 studi), untuk pasien yang tidak terkontrol dengan dosis maksimal atau maksimal sulfonilurea.
Dalam studi ini, kombinasi AVANDIA 4 mg atau 8 mg setiap hari (diberikan sebagai dosis terbagi tunggal atau dua kali sehari) dan sulfonilurea secara signifikan mengurangi FPG dan HbA1c dibandingkan dengan plasebo ditambah sulfonilurea atau titrasi lebih lanjut dari sulfonilurea. Tabel 11 menunjukkan data yang dikumpulkan untuk 8 studi di mana AVANDIA ditambahkan ke sulfonylurea dibandingkan dengan plasebo plus sulfonylurea.
Tabel 11. Parameter Glikemik dalam Studi Kombinasi 24 hingga 26 Minggu dari AVANDIA Plus Sulfonylurea
| Dosis Harian Terbagi Dua Kali (5 Studi) | Sulfonylurea N = 397 |
AVANDIA 2 mg dua kali sehari + sulfonilurea N = 497 |
Sulfonylurea N = 248 |
AVANDIA 4 mg dua kali sehari + sulfonilurea N = 346 |
| FPG (mg / dL) | ||||
| Baseline (rata-rata) | 204 | 198 | 188 | 187 |
| Ubah dari garis dasar (rata-rata) | 11 | -29 | 8 | -43 |
| Perbedaan dari sulfonylurea saja (berarti disesuaikan) | - | -42* | - | -53* |
| % pasien dengan â ‰ ¥ 30 mg / dL menurun dari awal | 17% | 49% | 15% | 61% |
| HbA1c (%) | ||||
| Baseline (rata-rata) | 9.4 | 9.5 | 9.3 | 9.6 |
| Ubah dari garis dasar (rata-rata) | 0.2 | -1.0 | 0.0 | -1.6 |
| Perbedaan dari sulfonylurea saja (berarti disesuaikan) | - | -1.1* | - | -1.4* |
| % pasien dengan â ‰ ¥ penurunan 0,7% dari awal | 21% | 60% | 23% | 75% |
| Dosis Setiap Hari (3 Studi) | Sulfonylurea N = 172 |
AVANDIA 4 mg sekali sehari + sulfonilurea N = 172 |
Sulfonylurea N = 173 |
AVANDIA 8 mg sekali sehari + sulfonilurea N = 176 |
| FPG (mg / dL) | ||||
| Baseline (rata-rata) | 198 | 206 | 188 | 192 |
| Ubah dari garis dasar (rata-rata) | 17 | -25 | 17 | -43 |
| Perbedaan dari sulfonylurea saja (berarti disesuaikan) | - | -47* | - | -66* |
| % pasien dengan â ‰ ¥ 30 mg / dL menurun dari awal | 17% | 48% | 19% | 55% |
| HbA1c (%) | ||||
| Baseline (rata-rata) | 8.6 | 8.8 | 8.9 | 8.9 |
| Ubah dari garis dasar (rata-rata) | 0.4 | -0.5 | 0.1 | -1.2 |
| Perbedaan dari sulfonylurea saja (berarti disesuaikan) | - | -0.9* | - | -1.4* |
| % pasien dengan â ‰ ¥ penurunan 0,7% dari awal | 11% | 36% | 20% | 68% |
| * p <0,0001 dibandingkan dengan sulfonylurea saja. |
Salah satu dari studi 24 hingga 26 minggu termasuk pasien yang tidak cukup terkontrol pada dosis maksimal glyburide dan beralih ke 4 mg AVANDIA setiap hari sebagai monoterapi; dalam kelompok ini, kehilangan kontrol glikemik ditunjukkan, dibuktikan dengan peningkatan FPG dan HbA1c.
Dalam studi double-blind 2-tahun, pasien usia lanjut (berusia 59-89 tahun) yang menggunakan sulfonilurea setengah maksimal (glipizide 10 mg dua kali sehari) diacak untuk penambahan AVANDIA (n = 115, 4 mg sekali sehari hingga 8 mg sesuai kebutuhan) atau untuk melanjutkan titrasi glipizide (n = 110), hingga maksimum 20 mg dua kali harian. Rata-rata baseline FPG dan HbA1c masing-masing adalah 157 mg / dL dan 7.72%, untuk AVANDIA plus lengan glipizide dan 159 mg / dL dan 7.65%, masing-masing, untuk lengan titrasi naik glipizide. Kehilangan kontrol glikemik (FPG 180 180 mg / dL) terjadi pada proporsi pasien yang secara signifikan lebih rendah (2%) pada AVANDIA plus glipizide dibandingkan dengan pasien dalam lengan titrasi naik glipizide (28,7%). Sekitar 78% dari pasien yang menggunakan terapi kombinasi menyelesaikan 2 tahun terapi sementara hanya 51% yang menyelesaikan monoterapi glipizide. Efek terapi kombinasi pada FPG dan HbA1c bertahan selama periode studi 2 tahun, dengan pasien mencapai rata-rata 132 mg / dL untuk FPG dan rata-rata 6,98% untuk HbA1c dibandingkan dengan tidak ada perubahan pada glipizide lengan.
Kombinasi Dengan Sulfonylurea Plus Metformin
Dalam dua studi 24 hingga 26 minggu, double-blind, terkontrol plasebo, yang dirancang untuk menilai kemanjuran dan keamanan AVANDIA dalam kombinasi dengan sulfonylurea plus metformin, AVANDIA 4 mg atau 8 mg setiap hari, diberikan dalam dosis terbagi dua kali sehari, untuk pasien yang tidak cukup terkontrol dengan dosis maksimum (10 mg) dan maksimal glikida (20 mg) dan dosis maksimum metformin (2). g / hari). Peningkatan signifikan secara statistik pada FPG dan HbA1c diamati pada pasien yang diobati dengan kombinasi sulfonylurea ditambah metformin dan 4 mg AVANDIA dan 8 mg AVANDIA dibandingkan pasien yang melanjutkan penggunaan sulfonylurea plus metformin, seperti yang ditunjukkan pada Tabel 12.
Tabel 12. Parameter Glikemik dalam Studi Kombinasi 26-minggu dari AVANDIA Plus Sulfonylurea dan Metformin
| Sulfonylurea + metformin N = 273 |
AVANDIA 2 mg dua kali harian + sulfonylurea + metformin N = 276 |
AVANDIA 4 mg dua kali sehari + sulfonilurea + metformin N = 277 |
|
| FPG (mg / dL) | |||
| Baseline (rata-rata) | 189 | 190 | 192 |
| Ubah dari garis dasar (rata-rata) | 14 | -19 | -40 |
| Perbedaan dari sulfonylurea plus metformin (rata-rata yang disesuaikan) | - | -30* | -52* |
| % pasien dengan â ‰ ¥ 30 mg / dL menurun dari awal | 16% | 46% | 62% |
| HbA1c (%) | |||
| Baseline (rata-rata) | 8.7 | 8.6 | 8.7 |
| Ubah dari garis dasar (rata-rata) | 0.2 | -0.4 | -0.9 |
| Perbedaan dari sulfonylurea plus metformin (rata-rata yang disesuaikan) | - | -0.6* | -1.1* |
| % pasien dengan â ‰ ¥ penurunan 0,7% dari awal | 16% | 39% | 63% |
| * p <0,0001 dibandingkan dengan plasebo. |
teratas
Referensi
- Dokumen Pengarahan Administrasi Makanan dan Obat-obatan. Pertemuan bersama Komite Obat Metabolik Endokino dan Keselamatan Obat dan Komite Penasihat Manajemen Risiko. Ju 2007.
- Penyelidik Percobaan MIMPI. Efek rosiglitazone pada frekuensi diabetes dengan toleransi glukosa terganggu atau glukosa puasa terganggu: kontrol acak Lanset 2006;368:1096-1105.
- Rumah PD, Pocock SJ, Beck-Nielsen H, et al. Rosiglitazone dievaluasi untuk hasil kardiovas - analisis sementara. NEJM 2007; 357: 1-11.
- Park JY, Kim KA, Kang MH, dkk. Efek rifampisin pada farmakokinetik rosiglitazone pada subyek sehat. Clin Pharmacol Ther 2004; 75: 157-162.
teratas
Bagaimana Disediakan / Penyimpanan dan Penanganan
Setiap tablet TILTAB berlapis film pentagonal mengandung rosiglitazone sebagai maleat sebagai berikut: 2 mg-merah muda, debossed dengan SB di satu sisi dan 2 di sisi lainnya; 4 mg-oranye, debossed dengan SB di satu sisi dan 4 di sisi lain; 8 mg-merah-coklat, debossed dengan SB di satu sisi dan 8 di sisi lain.
- 2 mg botol 60: NDC 0029-3158-18
- 4 mg botol 30: NDC 0029-3159-13
- 4 mg botol 90: NDC 0029-3159-00
- 8 mg botol 30: NDC 0029-3160-13
- 8 mg botol 90: NDC 0029-3160-59
Simpan pada 25 C (77 ° F); kunjungan 15 hingga 30 C (59 hingga 86 F). Buang dalam wadah yang ketat dan tahan cahaya.
terakhir diperbarui 02/2008
Avandia, rosiglitazone maleate, informasi pasien (dalam Bahasa Inggris)
Info Lengkap tentang Tanda, Gejala, Penyebab, Perawatan Diabetes
Informasi dalam monograf ini tidak dimaksudkan untuk mencakup semua kemungkinan penggunaan, arahan, tindakan pencegahan, interaksi obat atau efek samping. Informasi ini digeneralisasi dan tidak dimaksudkan sebagai saran medis khusus. Jika Anda memiliki pertanyaan tentang obat-obatan yang Anda pakai atau ingin informasi lebih lanjut, tanyakan kepada dokter, apoteker, atau perawat Anda.
kembali ke:Telusuri semua Obat untuk Diabetes



