Namenda: Obat Alzheimer
Namenda adalah obat yang digunakan dalam pengobatan Penyakit Alzheimer. Info lengkap tentang penggunaan, dosis, efek samping dari Namenda.
Nama Merek: Namenda
Nama Generik: Memantine hydrochloride
Namenda (memantine hydrochloride) adalah obat yang digunakan dalam pengobatan Penyakit Alzheimer. Info lengkap tentang penggunaan, dosis dan efek samping dari Namenda di bawah ini.
Isi:
Deskripsi
Farmakologi
Indikasi dan Penggunaan
Kontraindikasi
Tindakan pencegahan
Interaksi obat
Reaksi yang merugikan
Overdosis
Dosis
Disediakan
Instruksi Pasien
Informasi Pasien Namenda (dalam Bahasa Inggris)
Deskripsi
Namenda® (memantine hydrochloride) adalah antagonis reseptor NMDA yang aktif secara oral. Nama kimia untuk memantine hidroklorida adalah 1-amino-3,5-dimethyladamantane hidroklorida dengan rumus struktural berikut:
Sumber: Laboratorium Hutan, distributor A.S. atau Namenda.
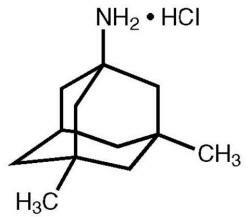
Rumus molekul adalah C 12 H 21 N · HCl dan berat molekul 215,76.
Memantine HCl muncul sebagai bubuk putih halus hingga putih dan larut dalam air. Namenda tersedia sebagai tablet atau sebagai solusi oral. Namenda tersedia untuk pemberian oral sebagai tablet berbentuk film berbentuk kapsul yang mengandung 5 mg dan 10 mg memantine hidroklorida. Tablet juga mengandung bahan-bahan tidak aktif berikut: selulosa mikrokristalin, laktosa monohidrat, silikon dioksida koloidal, bedak dan magnesium stearat. Selain itu bahan-bahan tidak aktif berikut ini juga hadir sebagai komponen lapisan film: hypromellose, triacetin, titanium dioksida, FD&C yellow # 6 dan FD&C blue # 2 (tablet 5 mg), iron oxide black (tablet 10 mg). Larutan oral Namenda mengandung memantine hidroklorida dalam kekuatan yang setara dengan 2 mg memantine hidroklorida dalam setiap mL. Larutan oral juga mengandung bahan-bahan tidak aktif berikut: larutan sorbitol (70%), metil paraben, propylparaben, propilen glikol, gliserin, rasa peppermint alami # 104, asam sitrat, natrium sitrat, dan murni air.
Farmakologi Klinis
Mekanisme Tindakan dan Farmakodinamik
Aktivasi reseptor N-metil-D-aspartat (NMDA) sistem saraf pusat yang persisten oleh glutamat asam amino rangsang telah dihipotesiskan untuk berkontribusi pada gejala Penyakit Alzheimer. Memantine dipostulatkan untuk mengerahkan efek terapeutiknya melalui aksinya sebagai afinitas rendah hingga sedang antagonis reseptor NMDA yang tidak kompetitif (saluran terbuka) yang mengikat secara istimewa pada reseptor yang dioperasikan oleh NMDA saluran kation. Tidak ada bukti bahwa memantine mencegah atau memperlambat degenerasi saraf pada pasien dengan penyakit Alzheimer.
Memantine menunjukkan afinitas rendah ke diabaikan untuk GABA, benzodiazepine, dopamin, adrenergik, histamin dan reseptor glisin dan untuk saluran Ca 2+, Na + atau K + yang bergantung pada tegangan. Memantine juga menunjukkan efek antagonis pada reseptor 5HT 3 dengan potensi yang mirip dengan itu untuk reseptor NMDA dan diblokir reseptor nikotinik asetilkolin dengan seperenam sampai sepersepuluh potensi.
Penelitian in vitro menunjukkan bahwa memantine tidak memengaruhi penghambatan reversibel asetilkolinesterase oleh donepezil, galantamine, atau tacrine.
Farmakokinetik
Memantine diserap dengan baik setelah pemberian oral dan memiliki farmakokinetik linier pada rentang dosis terapeutik. Ini diekskresikan terutama dalam urin, tidak berubah, dan memiliki paruh paruh eliminasi sekitar 60-80 jam.
Penyerapan dan Distribusi
Setelah pemberian oral, memantine sangat diserap dengan konsentrasi puncak mencapai sekitar 3-7 jam. Makanan tidak berpengaruh pada penyerapan memantine. Volume rata-rata distribusi memantine adalah 9-11 L / kg dan ikatan protein plasma rendah (45%).
Metabolisme dan Eliminasi
Memantine mengalami metabolisme hepatik parsial. Sekitar 48% dari obat yang diberikan diekskresikan tidak berubah dalam urin; sisanya dikonversi terutama menjadi tiga metabolit polar yang memiliki reseptor NMDA minimal aktivitas antagonis: konjugat N-glukuronida, 6-hidroksi memantin, dan 1-nitroso-deaminasi memantine. Sebanyak 74% dari dosis yang diberikan diekskresikan sebagai jumlah dari obat induk dan konjugat N-glukuronida. Sistem enzim CYP450 mikrosom hati tidak memainkan peran penting dalam metabolisme memantine. Memantine memiliki paruh eliminasi terminal sekitar 60-80 jam. Pembersihan ginjal melibatkan sekresi tubular aktif yang dimoderasi oleh reabsorpsi tubular yang tergantung pH.
Populasi Khusus
Gangguan ginjal: Farmakokinetik memantine dievaluasi setelah pemberian oral tunggal 20 mg memantine HCl pada 8 subjek dengan gangguan ginjal ringan (klirens kreatinin, CLcr,> 50 - 80 mL / mnt), 8 subjek dengan gangguan ginjal sedang (CLcr 30 - 49 mL / mnt), 7 subjek dengan gangguan ginjal berat (CLcr 5 - 29 mL / mnt) dan 8 subyek sehat (CLcr> 80 mL / mnt) dicocokkan sedekat mungkin dengan usia, berat dan jenis kelamin pada subyek dengan ginjal. penurunan nilai. Rata-rata AUC 0 (tanpa batas) meningkat sebesar 4%, 60%, dan 115% pada subjek dengan gangguan ginjal ringan, sedang, dan berat, masing-masing, dibandingkan dengan subyek sehat. Waktu paruh eliminasi terminal meningkat sebesar 18%, 41%, dan 95% pada subjek dengan gangguan ginjal ringan, sedang, dan berat, masing-masing, dibandingkan dengan subyek sehat.
Tidak disarankan penyesuaian dosis untuk pasien dengan gangguan ginjal ringan dan sedang. Dosis harus dikurangi pada pasien dengan gangguan ginjal berat (Lihat DOSIS DAN ADMINISTRASI).
Tua: Farmakokinetik Namenda pada subjek muda dan lansia serupa.
Jenis kelamin: Mengikuti pemberian multi dosis Namenda 20 mg b.i.d., wanita memiliki sekitar 45% paparan lebih tinggi daripada pria, tetapi tidak ada perbedaan dalam paparan ketika berat badan diperhitungkan.
Interaksi Obat-Obat
Substrat dari Enzim Mikrosomal: Studi in vitro menunjukkan bahwa pada konsentrasi yang melebihi yang terkait dengan kemanjuran, memantine tidak menginduksi isozim sitokrom P450 CYP1A2, CYP2C9, CYP2E1 dan CYP3A4 / 5. Selain itu, penelitian in vitro menunjukkan bahwa memantine menghasilkan penghambatan enzim CYP450 CYP1A2, CYP2A6, CYP2C9, CYP2D6, CYP2E1, dan CYP3A4 yang minimal. Data ini menunjukkan bahwa tidak ada interaksi farmakokinetik dengan obat yang dimetabolisme oleh enzim ini.
Inhibitor Enzim Mikrosomal: Karena memantine mengalami metabolisme minimal, dengan sebagian besar dosis diekskresikan dalam urin, interaksi antara memantine dan obat-obatan yang merupakan penghambat enzim CYP450 tidak mungkin. Penggunaan bersama Namenda dengan AChE inhibitor donepezil HCl tidak mempengaruhi farmakokinetik dari kedua senyawa.
Obat yang Dieliminasi melalui Mekanisme Ginjal: Memantine dihilangkan sebagian oleh sekresi tubular. Penelitian in vivo menunjukkan bahwa beberapa dosis hidroklorotiazid / triamterene diuretik (HCTZ / TA) tidak memengaruhi AUC memantine pada kondisi stabil. Memantine tidak mempengaruhi bioavailabilitas TA, dan menurunkan AUC dan Cmax HCTZ sekitar 20%. Pemberian bersama memantine dengan obat antihyperglycemic Glucovance® (glyburide dan metformin HCl) tidak memengaruhi farmakokinetik dari memantine, metformin, dan glyburide. Memantine tidak memodifikasi efek penurun glukosa serum Glucovance®, yang mengindikasikan tidak adanya interaksi farmakodinamik.
Obat yang membuat urin menjadi basa: Pembersihan memantine berkurang sekitar 80% dalam kondisi urin alkali pada pH 8. Oleh karena itu, perubahan pH urin menuju keadaan alkali dapat menyebabkan akumulasi obat dengan kemungkinan peningkatan efek samping. Obat-obatan yang meng-alkalinkan urin (mis. Penghambat karbonat anhidrase, natrium bikarbonat) diharapkan akan mengurangi eliminasi ginjal dari memantine.
Obat-obatan sangat terikat dengan protein plasma: Karena pengikatan protein plasma memantine rendah (45%), interaksi dengan obat yang sangat terikat dengan protein plasma, seperti warfarin dan digoxin, tidak mungkin.
UJI KLINIS
Efektivitas Namenda (memantine hidroklorida) sebagai pengobatan untuk pasien dengan penyakit Alzheimer sedang sampai parah ditunjukkan dalam 2 secara acak, studi klinis double-blind, terkontrol plasebo (Studi 1 dan 2) dilakukan di Amerika Serikat yang menilai fungsi kognitif dan fungsi sehari-hari. Usia rata-rata pasien yang berpartisipasi dalam dua percobaan ini adalah 76 dengan kisaran 50-93 tahun. Sekitar 66% pasien adalah wanita dan 91% pasien adalah ras Kaukasia.
Studi ketiga (Studi 3), dilakukan di Latvia, mendaftarkan pasien dengan demensia berat, tetapi tidak menilai fungsi kognitif sebagai titik akhir yang direncanakan.
Ukuran Hasil Penelitian: Dalam setiap studi AS, efektivitas Namenda ditentukan menggunakan kedua instrumen dirancang untuk mengevaluasi keseluruhan fungsi melalui penilaian terkait pengasuh, dan instrumen yang mengukur pengartian. Kedua studi menunjukkan bahwa pasien di Namenda mengalami peningkatan yang signifikan pada kedua tindakan dibandingkan dengan plasebo.
Fungsi sehari-hari dinilai dalam kedua studi menggunakan penyakit Alzheimer yang dimodifikasi. Studi Kooperatif - Aktivitas persediaan Kehidupan Sehari-hari (ADCS-ADL). ADCS-ADL terdiri dari baterai komprehensif pertanyaan ADL yang digunakan untuk mengukur kemampuan fungsional pasien. Setiap item ADL dinilai dari level tertinggi kinerja independen untuk menyelesaikan kerugian. Penyelidik melakukan inventarisasi dengan mewawancarai pengasuh yang akrab dengan perilaku pasien. Subset dari 19 item, termasuk peringkat dari kemampuan pasien untuk makan, berpakaian, mandi, telepon, perjalanan, berbelanja, dan melakukan pekerjaan rumah tangga lainnya telah divalidasi untuk penilaian pasien dengan sedang hingga berat demensia. Ini adalah ADCS-ADL yang dimodifikasi, yang memiliki rentang skor 0 hingga 54, dengan skor yang lebih rendah menunjukkan penurunan fungsional yang lebih besar.
Kemampuan Namenda untuk meningkatkan kinerja kognitif dinilai dalam kedua studi dengan Severe Impairment Battery (SIB), a instrumen multi-item yang telah divalidasi untuk evaluasi fungsi kognitif pada pasien dengan sedang hingga berat demensia. SIB meneliti aspek-aspek tertentu dari kinerja kognitif, termasuk unsur-unsur perhatian, orientasi, bahasa, memori, kemampuan visuospatial, konstruksi, praksis, dan interaksi sosial. Rentang penilaian SIB adalah dari 0 hingga 100, dengan skor yang lebih rendah menunjukkan gangguan kognitif yang lebih besar.
Studi 1 (Studi Dua Puluh Delapan Minggu)
Dalam penelitian berdurasi 28 minggu, 252 pasien dengan kemungkinan penyakit Alzheimer sedang hingga parah (didiagnosis oleh DSM-IV dan NINCDS-ADRDA kriteria, dengan skor Pemeriksaan Status Mini-Mental> / = 3 dan! - = 14 dan Tahapan Skala Kerusakan Global 5-6) diacak ke Namenda atau plasebo. Untuk pasien yang diacak ke Namenda, pengobatan dimulai dengan 5 mg sekali sehari dan meningkat setiap minggu dengan dosis 5 mg / hari dibagi menjadi dosis 20 mg / hari (10 mg dua kali sehari).
Efek pada ADCS-ADL:
Gambar 1 menunjukkan perjalanan waktu untuk perubahan dari awal dalam skor ADCS-ADL untuk pasien dalam dua kelompok perlakuan menyelesaikan 28 minggu penelitian. Pada 28 minggu pengobatan, perbedaan rata-rata dalam skor perubahan ADCS-ADL untuk pasien yang diobati Namenda dibandingkan dengan pasien yang menggunakan plasebo adalah 3,4 unit. Dengan menggunakan analisis yang didasarkan pada semua pasien dan meneruskan penelitian terakhir mereka ke depan (analisis LOCF), pengobatan Namenda secara statistik lebih unggul secara bermakna dibandingkan dengan plasebo.
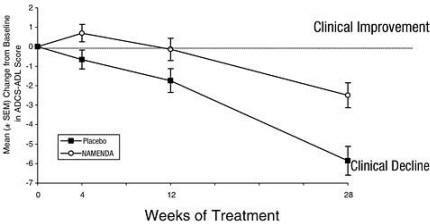
Gambar 1: Waktu perubahan dari baseline pada skor ADCS-ADL untuk pasien yang menyelesaikan 28 minggu perawatan.
Gambar 2 menunjukkan persentase kumulatif pasien dari masing-masing kelompok perlakuan yang telah mencapai setidaknya perubahan dalam ADCS-ADL yang ditunjukkan pada sumbu X.
Kurva menunjukkan bahwa kedua pasien yang ditugaskan untuk Namenda dan plasebo memiliki berbagai respon dan umumnya menunjukkan kemunduran (a perubahan negatif dalam ADCS-ADL dibandingkan dengan baseline), tetapi bahwa kelompok Namenda lebih cenderung menunjukkan penurunan yang lebih kecil atau perbaikan. (Dalam tampilan distribusi kumulatif, kurva untuk perawatan yang efektif akan digeser ke kiri kurva untuk plasebo, sementara pengobatan yang tidak efektif atau merusak akan ditumpangkan pada atau bergeser ke kanan kurva untuk plasebo.)
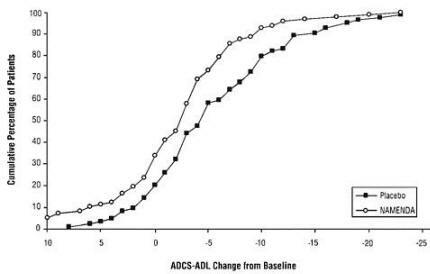
Gambar 2: Persentase kumulatif pasien yang menyelesaikan pengobatan double-blind 28 minggu dengan perubahan spesifik dari awal pada skor ADCS-ADL.
Efek pada SIB: Gambar 3 menunjukkan perjalanan waktu untuk perubahan dari awal dalam skor SIB untuk dua kelompok perlakuan selama 28 minggu penelitian. Pada 28 minggu pengobatan, perbedaan rata-rata dalam skor perubahan SIB untuk pasien yang diobati Namenda dibandingkan dengan pasien yang menggunakan plasebo adalah 5,7 unit. Menggunakan analisis LOCF, pengobatan Namenda secara statistik lebih unggul dibandingkan dengan plasebo.

Gambar 3: Waktu perubahan dari baseline dalam skor SIB untuk pasien yang menyelesaikan 28 minggu perawatan.
Gambar 4 menunjukkan persentase kumulatif pasien dari masing-masing kelompok perlakuan yang telah mencapai setidaknya ukuran perubahan dalam skor SIB yang ditunjukkan pada sumbu X.
Kurva menunjukkan bahwa kedua pasien yang ditugaskan untuk Namenda dan plasebo memiliki berbagai respon dan umumnya menunjukkan kemunduran, tetapi bahwa kelompok Namenda lebih cenderung menunjukkan penurunan yang lebih kecil atau perbaikan.
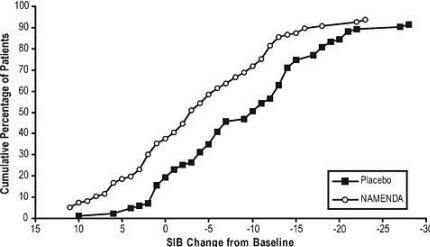
Gambar 4: Persentase kumulatif pasien yang menyelesaikan 28 minggu perawatan double-blind dengan perubahan spesifik dari awal dalam skor SIB.
Studi 2 (Studi Dua Puluh Empat Minggu) Dalam studi durasi 24 minggu, 404 pasien dengan sedang hingga berat kemungkinan penyakit Alzheimer (didiagnosis dengan kriteria NINCDS-ADRDA, dengan Mini-Mental State Examination skor ≥ 5 dan ≤ 14) yang telah dirawat dengan donepezil selama setidaknya 6 bulan dan yang telah menggunakan dosis stabil donepezil selama 3 bulan terakhir diacak ke Namenda atau plasebo saat masih menerima donepezil. Untuk pasien yang diacak ke Namenda, pengobatan dimulai pada 5 mg sekali sehari dan meningkat setiap minggu dengan 5 mg / hari dalam dosis terbagi dengan dosis 20 mg / hari (10 mg dua kali sehari).
Efek pada ADCS-ADL: Gambar 5 menunjukkan perjalanan waktu untuk perubahan dari awal dalam skor ADCS-ADL untuk dua kelompok perlakuan selama 24 minggu penelitian. Pada 24 minggu perawatan, perbedaan rata-rata dalam skor perubahan ADCS-ADL untuk Namenda / donepezil pasien yang diobati (terapi kombinasi) dibandingkan dengan pasien yang menggunakan plasebo / donepezil (monoterapi) adalah 1,6 unit. Dengan menggunakan analisis LOCF, perawatan Namenda / donepezil secara statistik lebih unggul secara bermakna dibandingkan dengan plasebo / donepezil.
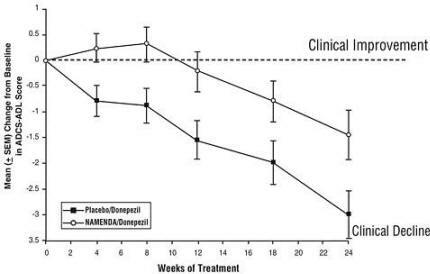
Gambar 5: Waktu perubahan dari baseline pada skor ADCS-ADL untuk pasien yang menyelesaikan 24 minggu perawatan.
Gambar 6 menunjukkan persentase kumulatif pasien dari masing-masing kelompok perlakuan yang telah mencapai setidaknya ukuran peningkatan dalam ADCS-ADL yang ditunjukkan pada sumbu X.
Kurva menunjukkan bahwa kedua pasien yang ditugaskan untuk Namenda / donepezil dan plasebo / donepezil memiliki berbagai tanggapan dan umumnya menunjukkan kemunduran, tetapi bahwa kelompok Namenda / donepezil lebih cenderung menunjukkan penurunan yang lebih kecil atau perbaikan.
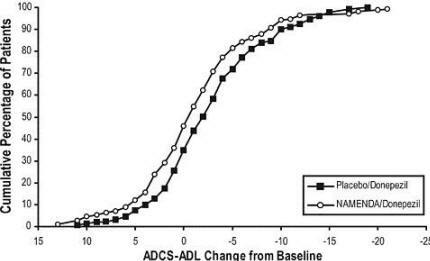
Gambar 6: Persentase kumulatif pasien yang menyelesaikan 24 minggu perawatan double-blind dengan perubahan spesifik dari awal dalam skor ADCS-ADL.
Efek pada SIB: Gambar 7 menunjukkan perjalanan waktu untuk perubahan dari awal dalam skor SIB untuk dua kelompok perlakuan selama 24 minggu penelitian. Pada 24 minggu pengobatan, perbedaan rata-rata dalam skor perubahan SIB untuk pasien yang diobati dengan Namenda / donepezil dibandingkan dengan pasien yang menggunakan plasebo / donepezil adalah 3,3 unit. Dengan menggunakan analisis LOCF, perawatan Namenda / donepezil secara statistik lebih unggul secara bermakna dibandingkan dengan plasebo / donepezil.
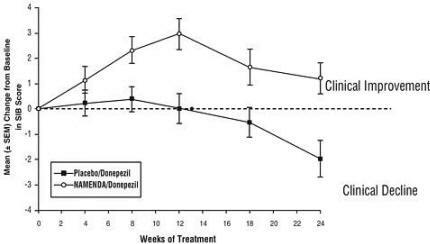
Gambar 7: Waktu perubahan dari baseline pada skor SIB untuk pasien yang menyelesaikan 24 minggu perawatan.
Gambar 8 menunjukkan persentase kumulatif pasien dari masing-masing kelompok perlakuan yang telah mencapai setidaknya ukuran peningkatan skor SIB yang ditunjukkan pada sumbu X.
Kurva menunjukkan bahwa kedua pasien yang ditugaskan untuk Namenda / donepezil dan plasebo / donepezil memiliki jangkauan luas tanggapan, tetapi bahwa kelompok Namenda / donepezil lebih cenderung menunjukkan peningkatan atau lebih kecil menurun.

Gambar 8: Persentase kumulatif pasien menyelesaikan 24 minggu perawatan double-blind dengan perubahan spesifik dari awal dalam skor SIB.
Study 3 (Twelve-Week Study) Dalam studi double-blind durasi 12 minggu, yang dilakukan di panti jompo di Latvia, 166 pasien dengan demensia menurut untuk DSM-III-R, skor Mini-Mental State Examination <10, dan skala Global Deterioration stage 5 hingga 7 secara acak untuk Namenda atau plasebo. Untuk pasien yang diacak ke Namenda, pengobatan dimulai dengan 5 mg sekali sehari dan meningkat menjadi 10 mg sekali sehari setelah 1 minggu. Ukuran efikasi primer adalah subskala ketergantungan perawatan dari Skala Penilaian Perilaku untuk Pasien Geriatri (BGP), ukuran fungsi sehari-hari, dan Clinical Global Impression of Change (CGI-C), ukuran klinis keseluruhan efek. Tidak ada ukuran valid fungsi kognitif yang digunakan dalam penelitian ini. Perbedaan pengobatan yang signifikan secara statistik pada 12 minggu yang mendukung Namenda dibandingkan dengan plasebo terlihat pada kedua langkah efikasi primer. Karena pasien yang dimasukkan adalah campuran penyakit Alzheimer dan demensia vaskular, upaya dilakukan untuk membedakan kedua kelompok dan semua pasien kemudian ditetapkan memiliki demensia vaskular atau penyakit Alzheimer, berdasarkan skor mereka pada Skala Iskemik Hachinski saat penelitian masuk. Hanya sekitar 50% pasien yang memiliki komputer tomografi otak. Untuk subset yang ditetapkan memiliki penyakit Alzheimer, efek pengobatan yang signifikan secara statistik yang mendukung Namenda dibandingkan dengan plasebo pada 12 minggu terlihat pada BGP dan CGI-C.
Indikasi dan Penggunaan
Namenda (memantine hydrochloride) diindikasikan untuk perawatan demensia tipe Alzheimer sedang hingga parah.
Kontraindikasi
Namenda (memantine hidroklorida) dikontraindikasikan pada pasien dengan hipersensitif terhadap memantine hidroklorida atau untuk eksipien yang digunakan dalam formulasi.
Tindakan pencegahan
Informasi untuk Pasien dan Pengasuh: Pengasuh harus diinstruksikan dalam pemberian yang direkomendasikan (dua kali per hari untuk dosis di atas 5 mg) dan peningkatan dosis (interval minimum satu minggu antara peningkatan dosis).
Kejang Kondisi Neurologis:
Namenda belum dievaluasi secara sistematis pada pasien dengan gangguan kejang. Dalam uji klinis Namenda, kejang terjadi pada 0,2% pasien yang diobati dengan Namenda dan 0,5% pasien yang diobati dengan plasebo.
Kondisi Genitourinari
Kondisi yang meningkatkan pH urin dapat menurunkan eliminasi memantine urin yang mengakibatkan peningkatan kadar memantine dalam plasma.
Populasi Khusus
Ggn hati
Namenda mengalami metabolisme hepatik parsial, dengan sekitar 48% dari dosis yang diberikan diekskresikan dalam urin sebagai obat yang tidak berubah atau sebagai jumlah dari obat induk dan konjugat N-glukuronida (74%). Farmakokinetik memantine pada pasien dengan gangguan hati belum diselidiki, tetapi diharapkan hanya sedikit terpengaruh.
Gangguan ginjal
Tidak diperlukan penyesuaian dosis pada pasien dengan gangguan ginjal ringan atau sedang. Pengurangan dosis dianjurkan pada pasien dengan gangguan ginjal berat (lihat FARMAKOLOGI KLINIS dan DOSIS DAN ADMINISTRASI ).
Interaksi Obat-Obat
N-metil-D-aspartat (NMDA) antagonis: Penggunaan gabungan Namenda dengan antagonis NMDA lainnya (amantadine, ketamine, dan dextromethorphan) belum dievaluasi secara sistematis dan penggunaan tersebut harus didekati dengan hati-hati.
Efek Namenda pada substrat enzim mikrosomal: Penelitian in vitro yang dilakukan dengan substrat marker enzim CYP450 (CYP1A2, -2A6, -2C9, -2D6, -2E1, -3A4) menunjukkan penghambatan minimal enzim ini oleh memantine. Selain itu, penelitian in vitro menunjukkan bahwa pada konsentrasi yang melebihi yang terkait dengan kemanjuran, memantine tidak menginduksi isozim sitokrom P450 CYP1A2, CYP2C9, CYP2E1 dan CYP3A4 / 5. Diharapkan tidak ada interaksi farmakokinetik dengan obat yang dimetabolisme oleh enzim ini.
Efek inhibitor dan / atau substrat enzim mikrosomal pada Namenda: Memantine sebagian besar dihilangkan secara renial, dan obat-obatan yang merupakan substrat dan / atau penghambat sistem CYP450 tidak diharapkan untuk mengubah metabolisme memantine.
Inhibitor Acetylcholinesterase (AChE): Penggunaan bersama Namenda dengan AChE inhibitor donepezil HCl tidak mempengaruhi farmakokinetik dari kedua senyawa. Dalam studi klinis terkontrol 24 minggu pada pasien dengan penyakit Alzheimer sedang hingga berat, yang merugikan profil acara diamati dengan kombinasi memantine dan donepezil mirip dengan donepezil saja.
Obat dieliminasi melalui mekanisme ginjal: Karena memantine dihilangkan sebagian oleh sekresi tubular, pemberian bersama obat-obatan yang menggunakan sistem kationik ginjal yang sama, termasuk hydrochlorothiazide (HCTZ), triamterene (TA), metformin, cimetidine, ranitidine, quinidine, dan nikotin, berpotensi menyebabkan perubahan kadar plasma dari kedua agen. Namun, pemberian bersama Namenda dan HCTZ / TA tidak mempengaruhi bioavailabilitas memantine atau TA, dan bioavailabilitas HCTZ menurun sebesar 20%. Selain itu, pemberian bersama memantine dengan obat antihyperglycemic Glucovance® (glyburide dan metformin HCl) tidak mempengaruhi farmakokinetik dari memantine, metformin dan glyburide. Lebih lanjut, memantine tidak memodifikasi efek penurun glukosa serum Glucovance®.
Obat yang membuat urin menjadi basa: Pembersihan memantine berkurang sekitar 80% dalam kondisi urin alkali pada pH 8. Oleh karena itu, perubahan pH urin ke arah kondisi basa dapat menyebabkan akumulasi obat dengan kemungkinan peningkatan efek samping. PH urin diubah oleh diet, obat-obatan (mis. Penghambat karbonat anhidrase, natrium bikarbonat) dan keadaan klinis pasien (mis. Asidosis tubulus ginjal atau infeksi parah pada saluran kemih). Oleh karena itu, memantine harus digunakan dengan hati-hati dalam kondisi ini.
Karsinogenesis, Mutagenesis, dan Penurunan Kesuburan
Tidak ada bukti karsinogenisitas dalam studi oral 113 minggu pada tikus dengan dosis hingga 40 mg / kg / hari (10 kali dosis manusia maksimum yang direkomendasikan [MRHD] berdasarkan mg / m2). Juga tidak ada bukti karsinogenisitas pada tikus yang diberi secara oral hingga 40 mg / kg / hari selama 71 minggu. diikuti oleh 20 mg / kg / hari (masing-masing 20 dan 10 kali MRHD berdasarkan mg / m2) hingga 128 minggu.
Memantine tidak menghasilkan bukti potensi genotoksik ketika dievaluasi dalam S. in vitro. typhimurium atau E. uji mutasi terbalik coli, uji aberasi kromosom in vitro pada limfosit manusia, uji sitogenetika in vivo untuk kerusakan kromosom pada tikus, dan uji mikronukleus tikus in vivo. Hasilnya samar-samar dalam uji mutasi gen in vitro menggunakan sel h79 Cina V79.
Tidak ada gangguan kesuburan atau kinerja reproduksi terlihat pada tikus yang diberikan hingga 18 mg / kg / hari (9 kali MRHD pada mg / m 2 basis) secara oral dari 14 hari sebelum kawin melalui kehamilan dan menyusui pada wanita, atau selama 60 hari sebelum kawin pada laki-laki
Kehamilan
Kategori Kehamilan B: Memantine yang diberikan secara oral kepada tikus hamil dan kelinci hamil selama periode organogenesis tidak teratogenik hingga dosis tertinggi yang diuji. (18 mg / kg / hari pada tikus dan 30 mg / kg / hari pada kelinci, masing-masing adalah 9 dan 30 kali, dosis manusia maksimum yang direkomendasikan [MRHD] pada mg / m 2 dasar).
Toksisitas ibu sedikit, penurunan berat badan anak anjing dan peningkatan insidensi vertebra serviks yang tidak keras terlihat pada mulut. dosis 18 mg / kg / hari dalam sebuah studi di mana tikus diberi memantine oral mulai pra-kawin dan berlanjut sampai postpartum Titik. Toksisitas ibu yang sedikit dan penurunan berat badan anak anjing juga terlihat pada dosis ini dalam sebuah studi di mana tikus dirawat dari hari ke 15 kehamilan melalui periode post-partum. Dosis tanpa efek untuk efek ini adalah 6 mg / kg, yang merupakan 3 kali MRHD pada basis mg / m2.
Tidak ada studi memantine yang memadai dan terkontrol dengan baik pada wanita hamil. Memantine harus digunakan selama kehamilan hanya jika manfaat potensial membenarkan potensi risiko pada janin.
Menyusui Ibu
Tidak diketahui apakah memantine diekskresikan dalam ASI. Karena banyak obat diekskresikan dalam ASI, kehati-hatian harus dilakukan ketika memantine diberikan kepada ibu menyusui.
Penggunaan Pediatrik
Tidak ada uji coba yang memadai dan terkontrol dengan baik yang mendokumentasikan keamanan dan kemanjuran memantine pada penyakit apa pun yang terjadi pada anak-anak.
Reaksi yang merugikan
Pengalaman yang dijelaskan dalam bagian ini berasal dari studi pada pasien dengan penyakit Alzheimer dan demensia vaskular.
Acara Merugikan yang Menuju Penghentian: Dalam uji coba terkontrol plasebo di mana pasien demensia menerima dosis Namenda hingga 20 mg / hari kemungkinan penghentian karena efek samping adalah sama pada kelompok Namenda seperti pada plasebo kelompok. Tidak ada efek samping individual yang dikaitkan dengan penghentian pengobatan pada 1% atau lebih dari pasien yang diobati dengan Namenda dan pada tingkat yang lebih besar dari plasebo.
Kejadian Buruk yang Dilaporkan dalam Uji Coba Terkendali: Efek samping yang dilaporkan dalam uji coba Namenda (memantine hydrochloride) mencerminkan pengalaman yang diperoleh dalam kondisi yang dipantau secara ketat pada populasi pasien yang sangat dipilih. Dalam praktik aktual atau dalam uji klinis lainnya, perkiraan frekuensi ini mungkin tidak berlaku, karena kondisi penggunaan, perilaku pelaporan dan jenis pasien yang dirawat mungkin berbeda. Tabel 1 daftar tanda-tanda dan gejala yang muncul pengobatan yang dilaporkan pada setidaknya 2% dari pasien yang terkontrol plasebo uji demensia dan yang tingkat kejadiannya lebih besar untuk pasien yang diobati dengan Namenda daripada mereka yang diobati dengan plasebo. Tidak ada efek samping yang terjadi pada frekuensi setidaknya 5% dan dua kali lipat dari tingkat plasebo.
Sistem Tubuh |
Placebo (N = 922) % |
Namenda (N = 940) % |
Tubuh sebagai Utuh | ||
Kelelahan |
1 | 2 |
Rasa sakit |
1 | 3 |
Sistem kardiovaskular | ||
Hipertensi |
2 | 4 |
Sistem Saraf Pusat dan Periferal | ||
Pusing |
5 | 7 |
Sakit kepala |
3 | 6 |
Sistem Gastrointestinal | ||
Sembelit |
3 | 5 |
Muntah |
2 | 3 |
Sistem Muskuloskeletal | ||
Sakit punggung |
2 | 3 |
Gangguan Jiwa | ||
Kebingungan |
5 | 6 |
Sifat tidur |
2 | 3 |
Halusinasi |
2 | 3 |
Sistem pernapasan | ||
Batuk |
3 | 4 |
Dispnea |
1 | 2 |
Efek samping lain yang terjadi dengan kejadian setidaknya 2% pada pasien yang diobati dengan Namenda tetapi pada tingkat yang lebih besar atau sama pada plasebo adalah agitasi, jatuh, cedera yang ditimbulkan, inkontinensia urin, diare, bronkitis, insomnia, infeksi saluran kemih, gejala seperti influenza, gaya berjalan abnormal, depresi, infeksi saluran pernapasan atas, kecemasan, edema perifer, mual, anoreksia, dan arthralgia.
Profil keseluruhan dari efek samping dan tingkat kejadian untuk efek samping individu dalam subpopulasi pasien dengan penyakit Alzheimer sedang hingga berat tidak berbeda dari profil dan tingkat kejadian yang dijelaskan di atas untuk demensia keseluruhan populasi.
Perubahan Tanda Vital: Namenda dan kelompok plasebo dibandingkan sehubungan dengan (1) perubahan rata-rata dari awal pada tanda-tanda vital (denyut nadi, tekanan darah sistolik, darah diastolik tekanan, dan berat badan) dan (2) kejadian pasien yang memenuhi kriteria untuk perubahan klinis yang berpotensi signifikan dari awal di ini variabel. Tidak ada perubahan penting secara klinis pada tanda-tanda vital pada pasien yang diobati dengan Namenda. Perbandingan ukuran tanda vital terlentang dan berdiri untuk Namenda dan plasebo pada subyek normal lansia menunjukkan bahwa perawatan Namenda tidak terkait dengan perubahan ortostatik.
Perubahan Laboratorium: Namenda dan kelompok plasebo dibandingkan sehubungan dengan (1) perubahan rata-rata dari awal dalam berbagai kimia serum, hematologi, dan variabel urinalisis dan (2) kejadian pasien yang memenuhi kriteria untuk perubahan klinis yang berpotensi signifikan dari awal variabel. Analisis ini mengungkapkan tidak ada perubahan klinis yang penting dalam parameter uji laboratorium yang terkait dengan pengobatan Namenda.
Perubahan EKG: Namenda dan kelompok plasebo dibandingkan sehubungan dengan (1) perubahan rata-rata dari awal dalam berbagai parameter EKG dan (2) kejadian pasien yang memenuhi kriteria untuk perubahan klinis yang berpotensi signifikan dari awal variabel. Analisis ini mengungkapkan tidak ada perubahan klinis yang penting dalam parameter EKG yang terkait dengan pengobatan Namenda.
Kejadian Buruk Lainnya Yang Diamati Selama Uji Klinis
Namenda telah diberikan kepada sekitar 1.350 pasien dengan demensia, di antaranya lebih dari 1.200 menerima dosis maksimum yang disarankan 20 mg / hari. Pasien menerima pengobatan Namenda untuk periode hingga 884 hari, dengan 862 pasien menerima setidaknya 24 minggu pengobatan dan 387 pasien menerima 48 minggu atau lebih pengobatan.
Pengobatan muncul tanda dan gejala yang terjadi selama 8 uji klinis terkontrol dan 4 label terbuka uji coba dicatat sebagai efek samping oleh peneliti klinis menggunakan terminologi mereka sendiri memilih. Untuk memberikan estimasi keseluruhan proporsi individu yang memiliki jenis peristiwa yang serupa, peristiwa tersebut dikelompokkan ke sejumlah kecil kategori standar menggunakan terminologi WHO, dan frekuensi acara dihitung di semua studi.
Semua efek samping yang terjadi pada setidaknya dua pasien dimasukkan, kecuali untuk yang sudah tercantum dalam Tabel 1, istilah WHO juga umum bersifat informatif, gejala atau peristiwa kecil yang tidak mungkin disebabkan oleh obat, mis., karena umum terjadi dalam penelitian populasi. Peristiwa diklasifikasikan berdasarkan sistem tubuh dan didaftar menggunakan definisi berikut: peristiwa merugikan yang sering terjadi - yang terjadi pada setidaknya 1/100 pasien; efek samping yang jarang terjadi - yang terjadi pada 1/100 hingga 1/1000 pasien. Efek samping ini tidak selalu terkait dengan pengobatan Namenda dan dalam kebanyakan kasus diamati pada frekuensi yang sama pada pasien yang diobati dengan plasebo dalam studi terkontrol.
Tubuh sebagai Utuh: Sering: sinkop. Jarang: hipotermia, reaksi alergi.
Sistem kardiovaskular: Sering: gagal jantung. Jarang: angina pectoris, bradikardia, infark miokard, tromboflebitis, fibrilasi atrium, hipotensi, henti jantung, hipotensi postural, emboli paru, edema paru.
Sistem Saraf Pusat dan Periferal: Sering: serangan iskemik transien, kecelakaan serebrovaskular, vertigo, ataksia, hipokinesia. Jarang: paresthesia, kejang-kejang, kelainan ekstrapiramidal, hipertensi, tremor, afasia, hipoestesi, abnormal koordinasi, hemiplegia, hiperkinesia, kontraksi otot tak sadar, pingsan, pendarahan otak, neuralgia, ptosis, sakit saraf.
Sistem Gastrointestinal: Jarang: gastroenteritis, divertikulitis, perdarahan gastrointestinal, melena, ulserasi esofagus.
Gangguan Hemik dan Limfatik: Sering: anemia. Jarang: leukopenia.
Gangguan Metabolik dan Gizi: Sering: peningkatan alkaline e phosphatase, penurunan berat badan. Jarang: dehidrasi, hiponatremia, diabetes mellitus yang parah.
Gangguan Jiwa: Sering: reaksi agresif. Jarang: khayalan, gangguan kepribadian, stabilitas emosi, gugup, gangguan tidur, libido meningkat, psikosis, amnesia, apatis, reaksi paranoid, berpikir tidak normal, menangis tidak normal, nafsu makan meningkat, paroniria, delirium, depersonalisasi, neurosis, bunuh diri mencoba.
Sistem pernapasan: Sering: pneumonia. Jarang: apnea, asma, hemoptisis.
Kulit dan Pelengkap: Sering: ruam. Jarang: ulserasi kulit, pruritus, selulitis, eksim, dermatitis, ruam eritematosa, alopesia, urtikaria.
Indra khusus: Sering: katarak, konjungtivitis. Jarang: degenerasi makula lutea, penurunan ketajaman visual, penurunan pendengaran, tinitus, blepharitis, penglihatan kabur, opacity kornea, glaukoma, perdarahan konjungtiva, nyeri mata, perdarahan retina, xerophthalmia, diplopia, lakrimasi abnormal, miopia, ablasi retina.
Sistem saluran kencing: Sering: sering berkemih. Jarang: disuria, hematuria, retensi urin.
Acara Dilaporkan Setelah Pemasaran Namenda, baik AS maupun Mantan AS
Meskipun tidak ada hubungan kausal dengan pengobatan memantine telah ditemukan, efek samping berikut telah dilaporkan secara temporer terkait dengan pengobatan memantine dan tidak dijelaskan di tempat lain dalam pelabelan: blok atrioventrikular, fraktur tulang, sindrom terowongan karpal, infark serebral, nyeri dada, klaudikasio, kolitis, diskinesia, disfagia, gastritis, refluks gastroesofagus, kejang grand mal, perdarahan intrakranial, gagal hati, hiperlipidemia, hipoglikemia, ileus, impotensi, malaise, sindrom maligna neuroleptik, akut pankreatitis, pneumonia aspirasi, gagal ginjal akut, interval QT yang berkepanjangan, gelisah, sindrom Stevens-Johnson, kematian mendadak, takikardia supraventrikular, takikardia, tardive diskinesia, dan trombositopenia.
TOKSIKOLOGI HEWAN
Lesi neuronal yang diinduksi memantine (vakuola dan nekrosis) pada sel multipolar dan piramidal pada lapisan kortikal III dan IV posterior neokorteks cingulate dan retrosplenial pada tikus, mirip dengan yang diketahui terjadi pada tikus yang diberikan antagonis reseptor NMDA lainnya. Lesi terlihat setelah memantine dosis tunggal. Dalam sebuah studi di mana tikus diberi dosis oral memantine harian selama 14 hari, dosis tidak ada efek untuk neuronal necrosis adalah 6 kali dosis manusia maksimum yang direkomendasikan berdasarkan mg / m2. Potensi untuk induksi vakuola neuron sentral dan nekrosis oleh antagonis reseptor NMDA pada manusia tidak diketahui.
Pelecehan dan ketergantungan obat
Kelas Substansi Terkendali: Memantine HCl bukan zat yang dikendalikan.
Ketergantungan Fisik dan Psikologis: Memantine HCl adalah antagonis NMDA afinitas rendah hingga sedang yang tidak menghasilkan bukti pencarian obat perilaku atau gejala penarikan setelah penghentian pada 2.504 pasien yang berpartisipasi dalam uji klinis di terapi dosis. Data pasca pemasaran, di luar AS, yang dikumpulkan secara retrospektif, tidak memberikan bukti penyalahgunaan atau ketergantungan obat.
Overdosis
Karena strategi untuk pengelolaan overdosis terus berkembang, disarankan untuk menghubungi a pusat pengendalian racun untuk menentukan rekomendasi terbaru untuk pengelolaan overdosis apa pun obat.
Seperti dalam kasus overdosis apa pun, tindakan suportif umum harus digunakan, dan pengobatan harus simtomatik. Eliminasi memantine dapat ditingkatkan dengan pengasaman urin. Dalam kasus overdosis hingga 400 mg memantine, pasien mengalami kegelisahan, psikosis, halusinasi visual, mengantuk, pingsan, dan kehilangan kesadaran. Pasien sembuh tanpa gejala sisa permanen.
Dosis dan Administrasi
Dosis Namenda (memantine hydrochloride) terbukti efektif dalam uji klinis terkontrol adalah 20 mg / hari.
Dosis awal Namenda yang direkomendasikan adalah 5 mg sekali sehari. Dosis target yang disarankan adalah 20 mg / hari. Dosis harus ditingkatkan dalam peningkatan 5 mg menjadi 10 mg / hari (5 mg dua kali sehari), 15 mg / hari (5 mg dan 10 mg sebagai dosis terpisah), dan 20 mg / hari (10 mg dua kali sehari). Interval minimum yang disarankan antara peningkatan dosis adalah satu minggu.
Namenda dapat dikonsumsi dengan atau tanpa makanan.
Pasien / pengasuh harus diinstruksikan tentang cara menggunakan perangkat dosis Namenda Oral Solution. Mereka harus mengetahui lembar instruksi pasien yang terlampir dengan produk. Pasien / pengasuh harus diinstruksikan untuk menjawab pertanyaan tentang penggunaan solusi untuk dokter atau apoteker mereka.
Dosis dalam Populasi Khusus
Dosis target 5 mg BID direkomendasikan pada pasien dengan gangguan ginjal berat (bersihan kreatinin 5 - 29 mL / menit berdasarkan persamaan Cockroft-Gault):
Untuk pria: CLcr = [140-usia (tahun)] · Berat (kg) / [72 · kreatinin serum (mg / dL)]
Untuk wanita: CLcr = 0,85 · [140-usia (tahun)] · Berat (kg) / [72 · kreatinin serum (mg / dL)]
Bagaimana Disediakan
5 mg Tablet:
Botol 60 NDC # 0456-3205-60
10 × 10 Unit Dosis NDC # 0456-3205-63
Tablet berbentuk film yang dilapisi kapsul berwarna kecokelatan, dengan kekuatan (5) dihilangkan di satu sisi dan FL di sisi lain.
10 mg Tablet:
Botol 60 NDC # 0456-3210-60
10 × 10 Unit Dosis NDC # 0456-3210-63
Tablet berbentuk film yang dilapisi kapsul berwarna abu-abu, dengan kekuatan (10) dihilangkan di satu sisi dan FL di sisi lain.
Titrasi Pak:
Paket PVC / Aluminium Blister yang mengandung 49 tablet. 28 × 5 mg dan 21 × 10 mg tablet. NDC # 0456-3200-14
Tablet 5 mg berbentuk kapsul berbentuk salut berwarna cokelat, dengan kekuatan (5) disingkirkan di satu sisi dan FL di sisi lainnya. Tablet 10 mg berbentuk kapsul berbentuk salut berwarna abu-abu, dengan kekuatan (10) dihilangkan di satu sisi dan FL di sisi lain.
Solusi Lisan:
Rekomendasi dosis untuk larutan oral sama dengan rekomendasi untuk tablet. Larutan oral jernih, bebas alkohol, bebas gula, dan beraroma peppermint.
2 mg / mL Larutan Oral (10 mg = 5 mL)
12 fl. ons (360 mL) botol NDC # 0456-3202-12
Simpan pada 25 ° C (77 ° F); kunjungan diizinkan ke 15-30 ° C (59-86 ° F) [lihat USP Controlled Room Temperature].
Forest Pharmaceuticals, Inc.
Anak perusahaan dari Forest Laboratories, Inc.
St. Louis, MO 63045
Dilisensikan dari Merz Pharmaceuticals GmbH
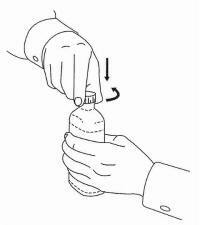
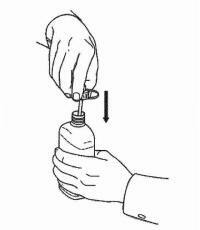
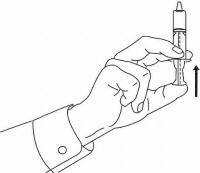
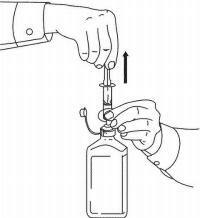
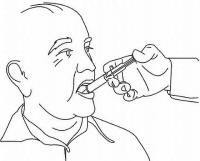
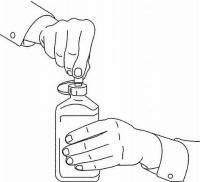
INSTRUKSI PASIEN UNTUK Solusi Oral NAMENDA®
Ikuti petunjuk di bawah ini untuk menggunakan perangkat dosis Solusi Namenda® Oral Anda.
PENTING: Baca instruksi ini sebelum menggunakan Namenda® Oral Solution.
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
PENTING: Informasi dalam monograf ini tidak dimaksudkan untuk mencakup semua kemungkinan penggunaan, arahan, tindakan pencegahan, interaksi obat atau efek samping. Informasi ini digeneralisasi dan tidak dimaksudkan sebagai saran medis khusus. Jika Anda memiliki pertanyaan tentang obat-obatan yang Anda pakai atau ingin informasi lebih lanjut, tanyakan kepada dokter, apoteker, atau perawat Anda. Terakhir diperbarui 4/07.
Sumber: Laboratorium Hutan, distributor AS Namenda.
Informasi Pasien Namenda (dalam Bahasa Inggris)
kembali ke: Halaman Utama Farmakologi Pengobatan Psikiatri


