Sitrat Kafein: Stimulan (Informasi Peresepan Lengkap)
Nama Merek: Cafcit
Nama Umum: Sitrat Kafein
Formulir Dosis: injeksi
Kafein sitrat adalah stimulan sistem saraf pusat yang tersedia sebagai Cafcit, digunakan untuk mengobati apnea pada bayi. Penggunaan, dosis, efek samping.
Isi:
Deskripsi
Farmakologi Klinis
Indikasi dan Penggunaan
Peringatan
Tindakan pencegahan
Reaksi yang merugikan
Overdosis
Dosis dan Administrasi
Bagaimana Disediakan
Caffeine citrate Informasi Pasien (dalam Bahasa Inggris)
Deskripsi
Baik injeksi Caffeine Citrate untuk pemberian intravena dan larutan oral Caffeine Citrate jelas, tidak berwarna, steril, non-pirogenik, bebas pengawet, larutan berair disesuaikan dengan pH 4.7. Setiap mL mengandung 20 mg Kafein Sitrat (setara dengan 10 mg basis kafein) disiapkan dalam solusi dengan penambahan 10 mg kafein anhidrat, USP hingga 5 mg asam sitrat monohidrat, USP, 8,3 mg natrium sitrat dihidrat, USP dan Air untuk Injeksi, USP.
Kafein, stimulan sistem saraf pusat, adalah bubuk atau butiran kristal putih tidak berbau, dengan rasa pahit. Ini sedikit larut dalam air dan etanol pada suhu kamar. Nama kimia kafein adalah 3,7-dihydro-1,3,7-trimethyl-1H-purine-2,6-dione. Di hadapan asam sitrat membentuk garam Kafein Sitrat dalam larutan. Rumus struktural dan berat molekul Kafein Sitrat berikut.
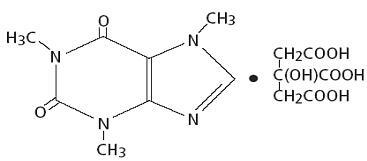
Sitrat Kafein
C14H18N4O9 Mol. Wt. 386.31
teratas
Farmakologi Klinis
Mekanisme aksi
Kafein secara struktural terkait dengan metilxantin lain, teofilin, dan teobromin. Ini adalah relaksan otot polos bronkial, stimulan SSP, stimulan otot jantung, dan diuretik.
lanjutkan cerita di bawah ini
Meskipun mekanisme kerja kafein dalam apnea prematuritas tidak diketahui, beberapa mekanisme telah dihipotesiskan. Ini termasuk: (1) stimulasi pusat pernapasan, (2) peningkatan ventilasi menit, (3) penurunan ambang batas untuk hiperkapnia, (4) peningkatan respons menjadi hypercapnia, (5) peningkatan tonus otot rangka, (6) penurunan kelelahan diafragma, (7) peningkatan laju metabolisme, dan (8) peningkatan oksigen konsumsi.
Sebagian besar efek ini telah dikaitkan dengan antagonisme reseptor adenosin, baik subtipe A1 dan A2, oleh kafein, yang telah ditunjukkan dalam uji ikatan reseptor dan diamati pada konsentrasi yang mendekati yang dicapai secara terapi.
Farmakokinetik
Penyerapan: Setelah pemberian oral 10 mg basis kafein / kg untuk bayi prematur, level plasma puncak (Cmaks) untuk kafein berkisar antara 6-10 mg / L dan waktu rata-rata untuk mencapai konsentrasi puncak (Tmaks) berkisar antara 30 menit hingga 2 jam. Tmaks tidak terpengaruh oleh pemberian susu formula. Namun bioavailabilitas absolut tidak sepenuhnya diperiksa pada neonatus prematur.
Distribusi: Kafein didistribusikan dengan cepat ke otak. Kadar kafein dalam cairan serebrospinal neonatus prematur mendekati kadar plasma mereka. Volume rata-rata distribusi kafein pada bayi (0,8-0,9 L / kg) sedikit lebih tinggi dari pada orang dewasa (0,6 L / kg). Data pengikatan protein plasma tidak tersedia untuk neonatus atau bayi. Pada orang dewasa, rata-rata pengikatan protein plasma secara in vitro dilaporkan sekitar 36%.
Metabolisme: Sitokrom hati P450 1A2 (CYP1A2) terlibat dalam biotransformasi kafein. Metabolisme kafein pada neonatus prematur terbatas karena sistem enzim hati yang belum matang.
Interkonversi antara kafein dan teofilin telah dilaporkan pada neonatus prematur; kadar kafein sekitar 25% dari kadar teofilin setelah pemberian theofilin dan sekitar 3-8% kafein yang diberikan diharapkan akan dikonversi menjadi teofilin.
Eliminasi: Pada bayi muda, eliminasi kafein jauh lebih lambat dibandingkan pada orang dewasa karena fungsi hati dan / atau ginjal yang belum matang. Waktu paruh (T1/2) dan fraksi diekskresikan tidak berubah dalam urin (Ae) kafein pada bayi telah terbukti berbanding terbalik dengan usia kehamilan / postkonseptual. Pada neonatus, T1/2 adalah sekitar 3-4 hari dan Ae sekitar 86% (dalam 6 hari). Pada usia 9 bulan, metabolisme kafein mendekati yang terlihat pada orang dewasa (T1/2 = 5 jam dan Ae = 1%).
Populasi Khusus: Penelitian yang meneliti farmakokinetik kafein pada neonatus dengan insufisiensi hati atau ginjal belum dilakukan. Kafein Sitrat harus diberikan dengan hati-hati pada neonatus prematur dengan gangguan fungsi ginjal atau hati. Konsentrasi serum kafein harus dipantau dan pemberian dosis Kafein Sitrat harus disesuaikan untuk menghindari toksisitas pada populasi ini.
Studi Klinis
Satu multicenter, uji coba acak, double-blind membandingkan Caffeine Citrate dengan plasebo pada delapan puluh lima (85) bayi prematur (usia kehamilan 28 hingga <33 minggu) dengan apnea prematuritas. Apnea prematur didefinisikan memiliki setidaknya 6 episode apnea dengan durasi lebih dari 20 detik dalam periode 24 jam tanpa ada penyebab apnea yang dapat diidentifikasi. Dosis Caffeine Citrate 1 mL / kg (20 mg / kg Kafein yang memberikan 10 mg / kg basa) memuat dosis Dosis Kafein diberikan secara intravena, diikuti oleh 0,25 mL / kg (5 mg / kg Kafein Sitrat memberikan 2,5 mg / kg basis kafein) dosis pemeliharaan harian diberikan baik secara intravena atau oral (umumnya melalui pemberian makan tabung). Durasi pengobatan dalam penelitian ini dibatasi hingga 10 hingga 12 hari. Protokol memungkinkan bayi untuk "diselamatkan" dengan label terbuka pengobatan Caffeine Citrate jika apnea mereka tetap tidak terkendali selama fase double-blind dari percobaan.
Persentase pasien tanpa apnea pada hari ke 2 pengobatan (24-48 jam setelah dosis dimuat) secara signifikan lebih besar dengan Kafein Sitrat daripada plasebo. Tabel berikut merangkum titik akhir yang relevan secara klinis yang dievaluasi dalam penelitian ini: klip
| Sitrat Kafein | Placebo | nilai p | |
|---|---|---|---|
| Jumlah pasien yang dievaluasi * | 45 | 37 | |
| % pasien dengan kejadian apnea nol pada hari ke 2 | 26.7 | 8.1 | 0.03 |
| Tingkat apnea pada hari ke 2 (per 24 jam) | 4.9 | 7.2 | 0.134 |
| % pasien dengan penurunan 50% pada kejadian apnea dari awal pada hari ke-2 | 76 | 57 | 0.07 |
| * Dari 85 pasien yang menerima obat, 3 tidak dimasukkan dalam analisis efikasi karena mereka memiliki <6 episode apnea / 24 jam pada awal. |
Dalam uji coba 10-12 hari ini, jumlah rata-rata hari dengan kejadian nol apnea adalah 3 pada kelompok Caffeine Citrate dan 1,2 pada kelompok plasebo. Jumlah rata-rata hari dengan pengurangan 50% dari awal pada kejadian apnea adalah 6,8 pada kelompok Caffeine Citrate dan 4,6 pada kelompok plasebo.
teratas
Indikasi dan Penggunaan
Caffeine Citrate injection dan Caffeine Citrate larutan oral diindikasikan untuk perawatan jangka pendek dari apnea prematuritas pada bayi antara 28 dan <33 minggu usia kehamilan.
teratas
Kontraindikasi
Injeksi Caffeine Citrate dan larutan oral Caffeine Citrate dikontraindikasikan pada pasien yang telah menunjukkan hipersensitivitas terhadap komponennya.
teratas
Peringatan
Selama uji klinis double-blind, terkontrol plasebo, 6 kasus necrotizing enterocolitis berkembang di antara 85 bayi yang diteliti (kafein = 46, plasebo = 39), dengan 3 kasus mengakibatkan kematian. Lima dari enam pasien dengan necrotizing enterocolitis secara acak atau telah terpapar Caffeine Citrate.
Laporan dalam literatur yang diterbitkan telah menimbulkan pertanyaan tentang kemungkinan hubungan antara penggunaan metilxantin dan pengembangan enterokolitis nekrotikans, meskipun hubungan sebab akibat antara penggunaan methylxanthine dan enterokolitis nekrotikans belum mapan. Oleh karena itu, seperti semua bayi prematur, pasien yang dirawat dengan Kafein Sitrat harus dimonitor secara hati-hati untuk pengembangan nekrotikan enterokolitis.
teratas
Tindakan pencegahan
Umum
Apnea prematuritas adalah diagnosis eksklusi. Penyebab lain dari apnea (mis., Gangguan sistem saraf pusat, penyakit paru-paru primer, anemia, sepsis, gangguan metabolisme, kelainan kardiovaskular, atau apnea obstruktif) harus disingkirkan atau diobati dengan benar sebelum memulai Kafein Garam sitrat.
Kafein adalah stimulan sistem saraf pusat dan dalam kasus overdosis kafein, kejang telah dilaporkan. Kafein Sitrat harus digunakan dengan hati-hati pada bayi dengan gangguan kejang.
Durasi pengobatan apnea prematuritas dalam uji coba terkontrol plasebo dibatasi hingga 10 hingga 12 hari. Keamanan dan kemanjuran Kafein Sitrat untuk periode perawatan yang lebih lama belum ditetapkan. Keamanan dan kemanjuran Kafein Sitrat untuk digunakan dalam pengobatan profilaksis kematian bayi mendadak sindrom (SIDS) atau sebelum ekstubasi pada bayi dengan ventilasi mekanik juga belum mapan.
Kardiovaskular
Meskipun tidak ada kasus toksisitas jantung yang dilaporkan dalam uji coba terkontrol plasebo, kafein telah terbukti meningkatkan denyut jantung, output ventrikel kiri, dan volume stroke dalam penelitian yang dipublikasikan. Oleh karena itu, Kafein Sitrat harus digunakan dengan hati-hati pada bayi dengan penyakit kardiovaskular.
Sistem Ginjal dan Hepatik
Kafein Sitrat harus diberikan dengan hati-hati pada bayi dengan gangguan fungsi ginjal atau hati. Konsentrasi serum kafein harus dipantau dan pemberian dosis Kafein Sitrat harus disesuaikan untuk menghindari toksisitas pada populasi ini. (Lihat Farmakologi Klinis, Eliminasi, Populasi Khusus.)
Informasi untuk Pasien
Orang tua / pengasuh pasien yang menerima larutan oral Caffeine Citrate harus menerima instruksi berikut:
- Larutan kafein Citrate oral tidak mengandung pengawet apa pun dan setiap vial hanya untuk penggunaan tunggal. Setiap bagian dari obat yang tidak digunakan harus dibuang.
- Adalah penting bahwa dosis larutan oral Caffeine Citrate diukur secara akurat, yaitu, dengan 1cc atau jarum suntik lain yang sesuai.
- Konsultasikan dengan dokter Anda jika bayi terus mengalami peristiwa apnea; jangan menambah dosis larutan oral Caffeine Citrate tanpa konsultasi medis.
- Konsultasikan dengan dokter Anda jika bayi mulai menunjukkan tanda-tanda intoleransi gastrointestinal, seperti perut kembung, muntah, atau tinja berdarah, atau tampak lesu.
- Kafein Larutan oral sitrat harus diperiksa secara visual untuk masalah partikulat dan perubahan warna sebelum pemberiannya. Botol yang mengandung larutan berwarna atau partikel yang terlihat harus dibuang.
Tes laboratorium
Sebelum memulai Sitrat Kafein, kadar serum kafein awal harus diukur dalam bayi yang sebelumnya dirawat dengan theophilin, sejak bayi prematur memetabolisme theophilin kafein. Demikian juga, kadar serum kafein pada awal harus diukur pada bayi yang lahir dari ibu yang mengonsumsi kafein sebelum melahirkan, karena kafein siap melintasi plasenta.
Dalam uji klinis terkontrol plasebo, kadar kafein berkisar antara 8 hingga 40 mg / L. Kisaran konsentrasi terapeutik plasma kafein tidak dapat ditentukan dari uji klinis terkontrol plasebo. Toksisitas serius telah dilaporkan dalam literatur ketika kadar kafein serum melebihi 50 mg / L. Konsentrasi kafein dalam serum mungkin perlu dimonitor secara berkala selama perawatan untuk menghindari toksisitas.
Dalam studi klinis yang dilaporkan dalam literatur, kasus hipoglikemia dan hiperglikemia telah diamati. Oleh karena itu, glukosa serum mungkin perlu dimonitor secara berkala pada bayi yang menerima Kafein Sitrat.
Interaksi obat
Cytochrome P450 1A2 (CYP1A2) dikenal sebagai enzim utama yang terlibat dalam metabolisme kafein. Oleh karena itu, kafein memiliki potensi untuk berinteraksi dengan obat yang substrat untuk CYP1A2, menghambat CYP1A2, atau menginduksi CYP1A2.
Beberapa data ada pada interaksi obat dengan kafein pada bayi prematur. Berdasarkan data orang dewasa, dosis rendah kafein mungkin diperlukan setelah pemberian obat yang dilaporkan mengurangi eliminasi kafein (mis., Cimetidine dan ketoconazole) dan dosis kafein yang lebih tinggi mungkin diperlukan setelah pemberian obat yang meningkatkan eliminasi kafein (mis., fenobarbital dan fenitoin).
Kafein diberikan bersamaan dengan ketoprofen mengurangi volume urin pada empat sukarelawan sehat. Signifikansi klinis dari interaksi ini pada neonatus prematur tidak diketahui.
Interkonversi antara kafein dan teofilin telah dilaporkan pada neonatus prematur. Penggunaan bersamaan dari obat-obatan ini tidak dianjurkan.
Karsinogenesis, Mutagenesis, Penurunan Kesuburan
Dalam studi 2 tahun pada tikus Sprague-Dawley, kafein (sebagai basis kafein) yang diberikan dalam air minum tidak bersifat karsinogenik pada tikus jantan dengan dosis hingga 102. mg / kg atau pada tikus betina dengan dosis hingga 170 mg / kg (masing-masing sekitar 2 dan 4 kali, dosis maksimum yang disarankan untuk memuat intravena untuk bayi pada mg / m2 dasar). Dalam studi 18 bulan pada tikus C57BL / 6, tidak ada bukti tumorigenitas terlihat pada dosis makanan hingga 55 mg / kg (kurang dari dosis maksimum yang disarankan untuk memuat intravena untuk bayi dengan mg / m2 dasar).
Kafein (sebagai basis kafein) meningkatkan pertukaran kromatid saudara (SCE) SCE / metafase sel (tergantung waktu paparan) dalam analisis metafase tikus in vivo. Kafein juga mempotensiasi genotoksisitas dari mutagen yang dikenal dan meningkatkan pembentukan mikronuklei (5 kali lipat) pada tikus yang kekurangan folat. Namun, kafein tidak meningkatkan penyimpangan kromosom dalam sel ovarium hamster Cina (CHO) in vitro dan tes limfosit manusia. tidak bersifat mutagenik dalam uji mutasi gen CHO / hipoksantin guanin fosforibosiltransferase (HGPRT) in vitro, kecuali pada sitotoksik konsentrasi. Selain itu, kafein tidak klastogenik dalam uji micronucleus mouse in vivo.
Kafein (sebagai basis kafein) diberikan kepada tikus jantan dengan dosis 50 mg / kg / hari secara subkutan (kira-kira sama dengan dosis pemuatan intravena maksimum yang direkomendasikan untuk bayi dengan dosis mg / m2 dasar) selama 4 hari sebelum kawin dengan betina yang tidak diobati, menyebabkan penurunan kinerja reproduksi pria selain menyebabkan embriotoksisitas. Selain itu, paparan jangka panjang terhadap dosis oral yang tinggi dari kafein (3 g selama 7 minggu) adalah racun bagi testis tikus yang dimanifestasikan oleh degenerasi sel spermatogenik.
Kehamilan: Kategori Kehamilan C
Kekhawatiran akan teratogenisitas kafein tidak relevan ketika diberikan kepada bayi. Dalam studi yang dilakukan pada hewan dewasa, kafein (sebagai basis kafein) diberikan pada tikus hamil pelet pelepasan berkelanjutan pada 50 mg / kg (kurang dari dosis pemuatan intravena maksimum yang disarankan untuk bayi) pada mg / m2 dasar), selama periode organogenesis, menyebabkan insidensi sumbing yang rendah dan eksensefali pada janin. Tidak ada studi yang memadai dan terkontrol dengan baik pada wanita hamil.
teratas
Reaksi yang merugikan
Secara keseluruhan, jumlah efek samping yang dilaporkan dalam periode double-blind dari uji coba terkontrol serupa untuk kelompok Caffeine Citrate dan placebo. Tabel berikut ini menunjukkan efek samping yang terjadi pada periode double-blind dari percobaan terkontrol dan yang lebih sering pada pasien yang diobati dengan Sitrat Kafein dibandingkan dengan plasebo.
| Kejadian Buruk (AE) | Sitrat Kafein N = 46 n (%) |
Placebo N = 39 n (%) |
|---|---|---|
| TUBUH SEBAGAI SELURUH | ||
| Cedera karena Kecelakaan | 1 (2.2) | 0 (0.0) |
| Intoleransi makan | 4 (8.7) | 2 (5.1) |
| Sepsis | 2 (4.3) | 0 (0.0) |
| SISTEM KARDIOVASKULAR | ||
| Pendarahan | 1 (2.2) | 0 (0.0) |
| SISTEM PENCERNAAN | ||
| Enterocolitis Nekrotikans | 2 (4.3) | 1 (2.6) |
| Radang perut | 1 (2.2) | 0 (0.0) |
| Perdarahan gastrointestinal | 1 (2.2) | 0 (0.0) |
| SISTEM HEMIC DAN LYMPHATIC | ||
| Koagulasi intravaskular diseminata | 1 (2.2) | 0 (0.0) |
| GANGGUAN METABOLIK DAN NUTRITIF | ||
| Asidosis | 1 (2.2) | 0 (0.0) |
| Penyembuhan Abnormal | 1 (2.2) | 0 (0.0) |
| SISTEM SARAF | ||
| Pendarahan otak | 1 (2.2) | 0 (0.0) |
| SISTEM PERNAPASAN | ||
| Dispnea | 1 (2.2) | 0 (0.0) |
| Edema paru-paru | 1 (2.2) | 0 (0.0) |
| KULIT DAN LAMPIRAN | ||
| Kulit kering | 1 (2.2) | 0 (0.0) |
| Ruam | 4 (8.7) | 3 (7.7) |
| Kerusakan kulit | 1 (2.2) | 0 (0.0) |
| SENSES KHUSUS | ||
| Retinopati Prematuritas | 1 (2.2) | 0 (0.0) |
| SISTEM UROGENITAL | ||
| Gagal ginjal | 1 (2.2) | 0 (0.0) |
Selain kasus-kasus di atas, tiga kasus necrotizing enterocolitis didiagnosis pada pasien yang menerima Caffeine Citrate selama fase label terbuka penelitian.
Tiga dari bayi yang mengalami enterokolitis nekrotikans selama persidangan meninggal. Semua telah terpapar kafein. Dua diacak untuk kafein, dan satu pasien plasebo "diselamatkan" dengan label terbuka kafein untuk apnea yang tidak terkontrol.
Kejadian buruk yang diuraikan dalam literatur yang diterbitkan meliputi: stimulasi sistem saraf pusat (mis., Lekas marah, gelisah, gelisah), efek kardiovaskular (mis., takikardia, peningkatan keluaran ventrikel kiri, dan peningkatan volume stroke), efek gastrointestinal (mis., peningkatan aspirasi lambung, intoleransi gastrointestinal), perubahan glukosa serum (hipoglikemia dan hiperglikemia) dan efek ginjal (peningkatan laju aliran urin, peningkatan bersihan kreatinin, dan peningkatan natrium dan kalsium pengeluaran). Studi tindak lanjut jangka panjang yang dipublikasikan belum menunjukkan kafein berdampak buruk terhadap perkembangan neurologis atau parameter pertumbuhan.
teratas
Overdosis
Setelah overdosis, kadar kafein serum telah berkisar dari sekitar 24 mg / L (pasca pemasaran) laporan kasus spontan di mana seorang bayi menunjukkan sifat lekas marah, kurang makan dan sulit tidur) sampai 350 mg / L. Toksisitas serius telah dikaitkan dengan kadar serum lebih besar dari 50 mg / L (lihat Tindakan pencegahanTes -Laboratory dan Dosis dan Administrasi). Tanda dan gejala yang dilaporkan dalam literatur setelah overdosis kafein pada bayi prematur termasuk demam, takipnea, gelisah, insomnia, tremor ekstremitas, hipertonia, opistotonos, gerakan tonik-klonik, gerakan rahang dan bibir yang tidak bertujuan, muntah, hiperglikemia, peningkatan urea nitrogen darah, dan peningkatan total leukosit konsentrasi. Kejang juga telah dilaporkan dalam kasus overdosis. Satu kasus overdosis kafein yang diperumit dengan pengembangan perdarahan intraventrikular dan sekuele neurologis jangka panjang telah dilaporkan. Kasus lain overdosis Kafein Sitrat (dari Selandia Baru) diperkirakan 600 mg Sitrat Kafein (sekitar 322 mg / kg) yang diberikan selama 40 menit diperumit oleh takikardia, depresi ST, gangguan pernapasan, gagal jantung, distensi lambung, asidosis, dan luka bakar ekstravasasi dengan nekrosis jaringan pada perifer intravena situs injeksi. Tidak ada kematian terkait dengan overdosis kafein yang dilaporkan terjadi pada bayi prematur.
Pengobatan overdosis kafein terutama bersifat simptomatik dan suportif. Tingkat kafein telah terbukti menurun setelah transfusi tukar. Konvulsi dapat diobati dengan pemberian diazepam intravena atau barbiturat seperti natrium pentobarbital.
teratas
Dosis dan Administrasi
Sebelum memulai Sitrat Kafein, kadar serum kafein awal harus diukur dalam bayi yang sebelumnya dirawat dengan theophilin, sejak bayi prematur memetabolisme theophilin kafein. Demikian juga, kadar serum kafein pada awal harus diukur pada bayi yang lahir dari ibu yang mengonsumsi kafein sebelum melahirkan, karena kafein siap melintasi plasenta.
Dosis pemuatan yang disarankan dan dosis pemeliharaan Caffeine Citrate mengikuti.
| Dosis Sitrat Kafein Volume |
Dosis Sitrat Kafein mg / kg |
Rute | Frekuensi | |
|---|---|---|---|---|
| Memuat Dosis | 1 mL / kg | 20 mg / kg | Intravena * (lebih dari 30 menit) | Satu kali |
| Dosis Pemeliharaan | 0,25 mL / kg | 5 mg / kg | Intravena * (lebih dari 10 menit) atau secara lisan | Setiap 24 jam ** |
| * Menggunakan pompa infus jarum suntik ** mulai 24 jam setelah dosis pemuatan |
CATATAN BAHWA DASAR KASUS KASUS ADALAH SATU-SETENGAH DOSA SAAT DIEKSPRESIKAN SEBAGAI Kafein Sitrat (mis., 20 mg Kafein Sitrat setara dengan 10 mg basis kafein).
Konsentrasi kafein dalam serum mungkin perlu dimonitor secara berkala selama perawatan untuk menghindari toksisitas. Toksisitas serius telah dikaitkan dengan kadar serum lebih besar dari 50 mg / L.
Injeksi Caffeine Citrate dan larutan oral Caffeine Citrate harus diperiksa secara visual untuk masalah partikulat dan perubahan warna sebelum pemberian. Botol yang mengandung larutan berwarna atau partikel yang terlihat harus dibuang.
Kompatibilitas Obat
Untuk menguji kompatibilitas obat dengan solusi intravena umum atau obat-obatan, 20 mL injeksi Caffeine Citrate dikombinasikan dengan 20 mL larutan atau obat, dengan pengecualian campuran Intralipid®, yang dikombinasikan sebagai 80 mL / 80 mL. Penampilan fisik dari solusi gabungan dievaluasi untuk presipitasi. Campuran dicampur selama 10 menit dan kemudian diuji untuk kafein. Pencampuran kemudian terus dicampur selama 24 jam, dengan pengambilan sampel lebih lanjut untuk uji kafein pada 2, 4, 8, dan 24 jam.
Berdasarkan pengujian ini, injeksi Caffeine Citrate, 60 mg / 3 mL stabil secara kimiawi selama 24 jam pada suhu kamar bila dikombinasikan dengan produk uji berikut.
- Injeksi Dextrose, USP 5%
- 50% Dextrose Injection USP
- Intralipid® 20% IV Emulsi Lemak
- Aminosyn® 8,5% Larutan Asam Amino Kristal
- Suntikan Dopamin HCI, USP 40 mg / mL diencerkan menjadi 0,6 mg / mL dengan Dextrose Injection, USP 5%
- Injeksi Kalsium Glukonat, USP 10% (0,465 mEq / Ca + 2 / mL)
- Heparin Sodium Injection, USP 1000 unit / mL diencerkan menjadi 1 unit / mL dengan Dextrose Injection, USP 5%
- Fentanyl Citrate Injection, USP 50 ug / mL diencerkan hingga 10 ug / mL dengan Dextrose Injection, USP 5%
teratas
Bagaimana Disediakan
Baik larutan Caffeine Citrate dan larutan oral Caffeine Citrate tersedia sebagai larutan bening, tidak berwarna, steril, tidak pirogenik, bebas pengawet, bebas dalam 5 mL botol kaca tidak berwarna. Botol injeksi Caffeine Citrate disegel dengan sumbat karet abu-abu dan segel aluminium flip off putih dicetak dengan "HANYA UNTUK PENGGUNAAN YANG LUAR BIASA" dengan warna merah. Botol larutan oral Caffeine Citrate disegel dengan sumbat karet abu-abu dan biru tua matte finish, flip off merobek segel aluminium dicetak dengan "HANYA UNTUK PENGGUNAAN ORAL - FLIP UP & TEAR" di putih.
Baik botol larutan injeksi dan oral mengandung 3 mL larutan pada konsentrasi 20 mg / mL Kafein Sitrat (60 mg / botol) setara dengan 10 mg / mL basa kafein (30 mg / botol).
Injeksi Kafein Sitrat, USP
NDC 47335-289-40: 3 mL vial, secara individual dikemas dalam karton.
Larutan sitrat kafein, USP
NDC 47335-290-44: 3 mL vial (BUKAN TAHAN ANAK), 10 vial per putih
wadah tahan polypropylene untuk anak.
Simpan pada 20 ° hingga 25 ° C (68 ° hingga 77 ° F); kunjungan diizinkan antara 15 ° dan 30 ° C (59 ° dan 86 ° F) [lihat USP Controlled Room Temperature].
Bebas pengawet. Hanya untuk sekali pakai. Buang bagian yang tidak digunakan.
PERHATIAN FARMASI: Lepaskan "Petunjuk Penggunaan" dari sisipan paket dan buang dengan resep larutan oral Caffeine Citrate.
Didistribusikan oleh:
Caraco Pharmaceutical Laboratories, Ltd.
1150 Elijah McCoy Drive, Detroit, MI 48202
Diproduksi oleh:
Sun Pharmaceutical Ind. Ltd.
Jalan Raya Halol-Baroda,
Halol-389 350, Gujarat, India.
terakhir diperbarui 02/2010
Caffeine citrate Informasi Pasien (dalam Bahasa Inggris)
Info Lengkap tentang Tanda, Gejala, Penyebab, Perawatan Gangguan Tidur
Informasi dalam monograf ini tidak dimaksudkan untuk mencakup semua kemungkinan penggunaan, arahan, tindakan pencegahan, interaksi obat atau efek samping. Informasi ini digeneralisasi dan tidak dimaksudkan sebagai saran medis khusus. Jika Anda memiliki pertanyaan tentang obat-obatan yang Anda pakai atau ingin informasi lebih lanjut, tanyakan kepada dokter, apoteker, atau perawat Anda.
kembali ke:
~ semua artikel tentang gangguan tidur


