Onglyza untuk Pengobatan Diabetes
Nama Merek: Onglyza
Nama Generik: Saxagliptin
Bentuk Dosis: tablet, dilapisi film
Isi:
Indikasi dan Penggunaan
Dosis dan Administrasi
Bentuk dan Kekuatan Dosis
Kontraindikasi
Peringatan dan pencegahan
Reaksi yang merugikan
Interaksi obat
Gunakan dalam Populasi Tertentu
Overdosis
Deskripsi
Farmakologi
Toksikologi Nonklinis
Studi Klinis
Bagaimana Disediakan
Informasi pasien Onglyza (dalam Bahasa Inggris)
Indikasi dan Penggunaan
Monoterapi dan Terapi Kombinasi
Onglyza diindikasikan sebagai tambahan untuk diet dan olahraga untuk meningkatkan kontrol glikemik pada orang dewasa dengan diabetes mellitus tipe 2. [Lihat Studi Klinis].
Keterbatasan Penting Penggunaan
Onglyza tidak boleh digunakan untuk pengobatan diabetes mellitus tipe 1 atau ketoasidosis diabetik, karena itu tidak akan efektif dalam pengaturan ini.
Onglyza belum diteliti dalam kombinasi dengan insulin.
teratas
Dosis dan Administrasi
Dosis yang Disarankan
Dosis Onglyza yang disarankan adalah 2,5 mg atau 5 mg sekali sehari diminum tanpa makan.
Pasien dengan Gangguan Ginjal
Tidak ada penyesuaian dosis untuk Onglyza direkomendasikan untuk pasien dengan gangguan ginjal ringan (kreatinin [CrCl]> 50 mL / menit).
Dosis Onglyza adalah 2,5 mg sekali sehari untuk pasien dengan gangguan ginjal sedang atau berat, atau dengan penyakit ginjal stadium akhir (ESRD) yang membutuhkan hemodialisis (pembersihan kreatinin [CrCl] â ‰ ¤50 mL / mnt). Onglyza harus diberikan setelah hemodialisis. Onglyza belum diteliti pada pasien yang menjalani dialisis peritoneal.
Karena dosis Onglyza harus dibatasi hingga 2,5 mg berdasarkan fungsi ginjal, penilaian fungsi ginjal dianjurkan sebelum inisiasi Onglyza dan sesudahnya secara berkala. Fungsi ginjal dapat diperkirakan dari kreatinin serum menggunakan rumus Cockcroft-Gault atau Modifikasi Diet dalam formula Penyakit Ginjal. [Lihat Farmakologi Klinis, Farmakokinetik.]
Inhibitor CYP3A4 / 5 yang kuat
Dosis Onglyza adalah 2,5 mg sekali sehari ketika digunakan bersama dengan sitokrom P450 3A4 / 5 (CYP3A4 / 5) inhibitor yang kuat (mis., ketoconazole, atazanavir, clarithromycin, indinavir, itraconazole, nefazodone, nelfinavir, ritonavir, saquinavir, dan telithromycin). [Lihat Interaksi obat, Inhibitor dari CYP3A4 / 5 Enzim dan Farmakologi Klinis, Farmakokinetik.]
teratas
Bentuk dan Kekuatan Dosis
- Tablet Onglyza (saxagliptin) 5 mg berwarna pink, bikonveks, bulat, tablet salut film dengan "5" dicetak di satu sisi dan "4215" dicetak di sisi sebaliknya, dengan tinta biru.
- Tablet Onglyza (saxagliptin) 2,5 mg berwarna kuning pucat hingga kuning muda, bikonveks, bulat, tablet salut film dengan "2,5" dicetak di satu sisi dan "4214" dicetak di sisi sebaliknya, dengan tinta biru.
teratas
Kontraindikasi
Tidak ada
teratas
Peringatan dan pencegahan
Gunakan dengan Obat yang Dikenal Menyebabkan Hipoglikemia
Sekretagog insulin, seperti sulfonilurea, menyebabkan hipoglikemia. Oleh karena itu, dosis yang lebih rendah dari insulin secretagogue mungkin diperlukan untuk mengurangi risiko hipoglikemia ketika digunakan dalam kombinasi dengan Onglyza. [Lihat Reaksi yang merugikan, Pengalaman Uji Coba Klinis.]
Hasil Makrovaskular
Belum ada penelitian klinis yang membuktikan bukti konklusif pengurangan risiko makrovaskular dengan Onglyza atau obat antidiabetik lainnya.
teratas
Reaksi yang merugikan
Pengalaman Uji Coba Klinis
Karena uji klinis dilakukan dalam berbagai kondisi, laju reaksi merugikan diamati dalam uji klinis a obat tidak dapat secara langsung dibandingkan dengan tingkat dalam uji klinis obat lain dan mungkin tidak mencerminkan tingkat yang diamati praktek.
Monoterapi dan Terapi Kombinasi Add-On
Dalam dua percobaan monoterapi terkontrol plasebo dengan durasi 24 minggu, pasien diobati dengan Onglyza 2,5 mg setiap hari, Onglyza 5 mg setiap hari, dan plasebo. Tiga 24 minggu, terkontrol plasebo, terapi kombinasi add-on juga dilakukan: satu dengan metformin, satu dengan thiazolidinedione (pioglitazone atau rosiglitazone), dan satu dengan glyburide. Dalam tiga percobaan ini, pasien diacak untuk menambahkan terapi dengan Onglyza 2,5 mg setiap hari, Onglyza 5 mg setiap hari, atau plasebo. Kelompok pengobatan saxagliptin 10 mg dimasukkan dalam salah satu uji monoterapi dan dalam uji coba kombinasi add-on dengan metformin.
Dalam analisis kumpulan data 24 minggu yang ditentukan sebelumnya (terlepas dari penyelamatan glikemik) dari dua uji monoterapi, uji coba add-on to metformin, uji coba add-on untuk uji tiazolidinedione (TZD), dan tambahan pada uji coba glyburide, kejadian keseluruhan dari efek samping pada pasien yang diobati dengan Onglyza 2,5 mg dan Onglyza 5 mg mirip dengan plasebo (72,0% dan 72,2% berbanding 70,6%, masing-masing). Penghentian terapi karena efek samping terjadi pada masing-masing 2,2%, 3,3%, dan 1,8% pasien yang menerima Onglyza 2,5 mg, Onglyza 5 mg, dan plasebo. Efek samping yang paling umum (dilaporkan pada setidaknya 2 pasien yang diobati dengan Onglyza 2,5 mg atau setidaknya 2 pasien yang diobati dengan Onglyza 5 mg) terkait dengan penghentian terapi prematur termasuk limfopenia (0,1% dan 0,5% berbanding 0%, masing-masing), ruam (0,2% dan 0,3% berbanding 0,3%), kreatinin darah meningkat (0,3% dan 0% versus 0%), dan kreatinin fosfokinase darah meningkat (0,1% dan 0,2% dibandingkan 0%). Reaksi yang merugikan dalam analisis gabungan ini dilaporkan (terlepas dari penilaian peneliti atas kausalitas) di â ‰ ¥ 5% dari pasien yang diobati dengan Onglyza 5 mg, dan lebih umum daripada pasien yang diobati dengan plasebo ditunjukkan pada Tabel 1.
Tabel 1: Reaksi yang Merugikan (Terlepas dari Penilaian Investigator Kausalitas) di Uji Coba yang Terkontrol Plasebo * Dilaporkan dalam â ‰ ¥ 5% dari Pasien yang Diobati dengan Onglyza 5 mg dan Lebih Umum dari pada Pasien yang Diobati dengan Placebo
| Jumlah (%) Pasien | ||
|---|---|---|
| Onglyza 5 mg N = 882 |
Placebo N = 799 |
|
| * 5 uji coba terkontrol plasebo mencakup dua uji coba monoterapi dan satu uji coba terapi kombinasi tambahan dengan masing-masing berikut ini: metformin, thiazolidinedione, atau glyburide. Tabel menunjukkan data 24 minggu terlepas dari penyelamatan glikemik. | ||
| Infeksi saluran pernapasan atas | 68 (7.7) | 61 (7.6) |
| Infeksi saluran kemih | 60 (6.8) | 49 (6.1) |
| Sakit kepala | 57 (6.5) | 47 (5.9) |
Pada pasien yang diobati dengan Onglyza 2,5 mg, sakit kepala (6,5%) adalah satu-satunya reaksi buruk yang dilaporkan pada tingkat â ‰ ¥ 5% dan lebih umum daripada pasien yang diobati dengan plasebo.
Dalam analisis gabungan ini, reaksi merugikan yang dilaporkan pada â ‰ ¥ 2% pasien yang diobati dengan Onglyza 2,5 mg atau Onglyza 5 mg dan â ‰ ¥ 1% lebih sering dibandingkan dengan plasebo termasuk: sinusitis (2,9% dan 2,6% berbanding 1,6%, masing-masing), sakit perut (2,4% dan 1,7% berbanding 0,5%), gastroenteritis (1,9% dan 2,3% berbanding 0,9%), dan muntah (2,2% dan 2,3% berbanding 1,3%) ).
Dalam add-on untuk uji TZD, insidensi edema perifer lebih tinggi untuk Onglyza 5 mg dibandingkan dengan plasebo (masing-masing 8,1% dan 4,3%). Insiden edema perifer untuk Onglyza 2,5 mg adalah 3,1%. Tak satu pun dari efek samping yang dilaporkan dari edema perifer mengakibatkan penghentian obat studi. Tingkat edema perifer untuk Onglyza 2,5 mg dan Onglyza 5 mg dibandingkan plasebo adalah 3,6% dan 2% berbanding 3% diberikan sebagai monoterapi, 2,1% dan 2,1% dibandingkan 2,2% diberikan sebagai terapi tambahan untuk metformin, dan 2,4% dan 1,2% dibandingkan 2,2% diberikan sebagai terapi tambahan untuk glyburide.
Tingkat kejadian patah tulang adalah 1,0 dan 0,6 per 100 pasien-tahun, masing-masing, untuk Onglyza (analisis gabungan 2,5 mg, 5 mg, dan 10 mg) dan plasebo. Tingkat kejadian fraktur pada pasien yang menerima Onglyza tidak meningkat dari waktu ke waktu. Kausalitas belum ditetapkan dan studi nonklinis belum menunjukkan efek samping dari saxagliptin pada tulang.
Peristiwa trombositopenia, konsisten dengan diagnosis purpura trombositopenik idiopatik, diamati dalam program klinis. Hubungan acara ini dengan Onglyza tidak diketahui.
Efek Samping yang Berhubungan dengan Onglyza Coadministered dengan Metformin pada Pasien yang Tidak Mengobati dengan Diabetes Tipe 2
Tabel 2 menunjukkan reaksi merugikan yang dilaporkan (terlepas dari penilaian investigasi kausalitas) pada â ‰ ¥ 5% pasien berpartisipasi dalam percobaan 24-minggu tambahan, kontrol aktif terkontrol dari Onglyza dan metformin dalam naif pengobatan pasien.
Tabel 2: Terapi Awal dengan Kombinasi Onglyza dan Metformin pada Pasien yang belum pernah menggunakan pengobatan: Reaksi yang merugikan dilaporkan (Terlepas dari Penilaian Investigator) Kausalitas) pada â ‰ ¥ 5% Pasien yang Diobati dengan Terapi Kombinasi Metformin Onglyza 5 mg Plus (dan Lebih Umum daripada Pasien yang Diobati dengan Metformin) Sendirian)
| Jumlah (%) Pasien | ||
|---|---|---|
| Onglyza 5 mg + Metformin * N = 320 |
Metformin * N = 328 |
|
| * Metformin dimulai dengan dosis awal 500 mg setiap hari dan dititrasi hingga maksimum 2000 mg setiap hari. | ||
| Sakit kepala | 24 (7.5) | 17 (5.2) |
| Nasofaringitis | 22 (6.9) | 13 (4.0) |
Hipoglikemia
Efek samping dari hipoglikemia didasarkan pada semua laporan hipoglikemia; pengukuran glukosa bersamaan tidak diperlukan. Dalam studi add-on untuk glyburide, keseluruhan insiden hipoglikemia yang dilaporkan lebih tinggi untuk Onglyza 2,5 mg dan Onglyza 5 mg (13,3% dan 14,6%) dibandingkan dengan plasebo (10,1%). Insiden hipoglikemia dikonfirmasi dalam penelitian ini, didefinisikan sebagai gejala hipoglikemia disertai oleh a nilai glukosa ujung jari dari ‰ ¤50 mg / dL, adalah 2,4% dan 0,8% untuk Onglyza 2,5 mg dan Onglyza 5 mg dan 0,7% untuk plasebo. Insiden hipoglikemia yang dilaporkan untuk Onglyza 2,5 mg dan Onglyza 5 mg dibandingkan dengan plasebo yang diberikan sebagai monoterapi adalah 4,0% dan 5,6% dibandingkan 4,1%, masing-masing, 7,8% dan 5,8% dibandingkan 5% diberikan sebagai terapi tambahan untuk metformin, dan 4,1% dan 2,7% dibandingkan 3,8% diberikan sebagai terapi tambahan untuk TZD. Insiden hipoglikemia yang dilaporkan adalah 3,4% pada pasien yang belum pernah menggunakan pengobatan yang diberi Onglyza 5 mg plus metformin dan 4,0% pada pasien yang diberikan metformin saja.
Reaksi Hipersensitivitas
Peristiwa terkait hipersensitivitas, seperti urtikaria dan edema wajah dalam analisis gabungan 5 studi hingga Minggu 24 dilaporkan dalam 1,5%, 1,5%, dan 0,4% dari pasien yang menerima Onglyza 2,5 mg, Onglyza 5 mg, dan plasebo, masing-masing. Tak satu pun dari peristiwa ini pada pasien yang menerima Onglyza diperlukan rawat inap atau dilaporkan sebagai mengancam jiwa oleh para peneliti. Satu pasien yang diobati dengan saxagliptin dalam analisis yang dikumpulkan ini dihentikan karena urtikaria umum dan edema wajah.
Tanda-tanda vital
Tidak ada perubahan bermakna secara klinis pada tanda-tanda vital yang telah diamati pada pasien yang diobati dengan Onglyza.
Tes laboratorium
Jumlah Limfosit Absolut
Ada penurunan rata-rata terkait dosis dalam jumlah limfosit absolut yang diamati dengan Onglyza. Dari baseline rata-rata jumlah limfosit absolut sekitar 2200 sel / mikroL, rata-rata penurunan sekitar 100 dan 120 sel / mikroL dengan Onglyza 5 mg dan 10 mg, masing-masing, relatif terhadap plasebo diamati pada 24 minggu dalam analisis gabungan dari lima klinis terkontrol plasebo studi. Efek serupa diamati ketika Onglyza 5 mg diberikan dalam kombinasi awal dengan metformin dibandingkan dengan metformin saja. Tidak ada perbedaan yang diamati untuk Onglyza 2,5 mg relatif terhadap plasebo. Proporsi pasien yang dilaporkan memiliki jumlah limfosit â ‰ 50750 sel / mikroL adalah 0,5%, 1,5%, 1,4%, dan 0,4% masing-masing dalam kelompok saxagliptin 2,5 mg, 5 mg, 10 mg, dan plasebo. Pada kebanyakan pasien, kekambuhan tidak diamati dengan paparan berulang pada Onglyza meskipun beberapa pasien mengalami penurunan berulang pada rechallenge yang menyebabkan penghentian Onglyza. Penurunan jumlah limfosit tidak terkait dengan efek samping yang relevan secara klinis.
Signifikansi klinis dari penurunan jumlah limfosit ini relatif terhadap plasebo tidak diketahui. Ketika ditunjukkan secara klinis, seperti dalam pengaturan infeksi yang tidak biasa atau berkepanjangan, jumlah limfosit harus diukur. Efek Onglyza pada jumlah limfosit pada pasien dengan kelainan limfosit (mis., Human immunodeficiency virus) tidak diketahui.
Trombosit
Onglyza tidak menunjukkan efek yang bermakna secara klinis atau konsisten pada jumlah trombosit dalam enam, uji klinis terkontrol ganda, terkontrol dan efikasi.
teratas
Interaksi obat
Induser dari CYP3A4 / 5 Enzim
Rifampin secara signifikan mengurangi paparan saxagliptin tanpa perubahan di area di bawah kurva konsentrasi waktu (AUC) dari metabolit aktifnya, 5-hydroxy saxagliptin. Penghambatan aktivitas plasma dipeptidyl peptidase-4 (DPP4) selama interval dosis 24 jam tidak terpengaruh oleh rifampisin. Oleh karena itu, penyesuaian dosis Onglyza tidak dianjurkan. [Lihat Farmakologi Klinis, Farmakokinetik.]
Inhibitor dari CYP3A4 / 5 Enzim
Inhibitor Sedang CYP3A4 / 5
Diltiazem meningkatkan pajanan saksagliptin. Peningkatan serupa dalam konsentrasi plasma saxagliptin diantisipasi dengan adanya CYP3A4 / 5 moderat lainnya inhibitor (mis., amprenavir, aprepitant, erythromycin, fluconazole, fosamprenavir, jus jeruk bali, dan verapamil); Namun, penyesuaian dosis Onglyza tidak dianjurkan. [Lihat Farmakologi Klinis, Farmakokinetik.]
Penghambat Kuat CYP3A4 / 5
Ketoconazole secara signifikan meningkatkan paparan saxagliptin. Peningkatan signifikan yang serupa dalam konsentrasi plasma saxagliptin diantisipasi dengan inhibitor CYP3A4 / 5 kuat lainnya (mis., atazanavir, klaritromisin, indinavir, itrakonazol, nefazodon, nelfinavir, ritonavir, saquinavir, dan telithromycin). Dosis Onglyza harus dibatasi hingga 2,5 mg bila digunakan bersama dengan inhibitor CYP3A4 / 5 yang kuat. [Lihat Dosis dan Administrasi, Inhibitor CYP3A4 / 5 Kuat dan Farmakologi Klinis, Farmakokinetik.]
teratas
Gunakan dalam Populasi Tertentu
Kehamilan
Kategori Kehamilan B
Tidak ada studi yang memadai dan terkontrol dengan baik pada wanita hamil. Karena studi reproduksi hewan tidak selalu memprediksi respons manusia, Onglyza, seperti obat antidiabetik lainnya, harus digunakan selama kehamilan hanya jika jelas diperlukan.
Saxagliptin tidak teratogenik pada dosis apa pun yang diuji ketika diberikan pada tikus hamil dan kelinci selama periode organogenesis. Osifikasi panggul yang tidak lengkap, suatu bentuk keterlambatan perkembangan, terjadi pada tikus dengan dosis 240 mg / kg, atau sekitar 1503 dan 66 kali paparan manusia terhadap saxagliptin dan metabolit aktif, masing-masing, pada dosis manusia maksimum yang direkomendasikan (MRHD) 5 mg. Toksisitas ibu dan penurunan berat badan janin diamati pada 7986 dan 328 kali paparan manusia di MRHD untuk saxagliptin dan metabolit aktif, masing-masing. Variasi kerangka minor pada kelinci terjadi pada dosis toksik maternal 200 mg / kg, atau sekitar 1432 dan 992 kali MRHD. Ketika diberikan pada tikus dalam kombinasi dengan metformin, saxagliptin tidak teratogenik atau embrioletik pada paparan 21 kali saxagliptin MRHD. Pemberian kombinasi metformin dengan dosis tinggi saxagliptin (109 kali saxagliptin MRHD) dikaitkan dengan craniorachischisis (cacat tabung saraf langka yang ditandai dengan penutupan tengkorak dan tulang belakang yang tidak lengkap) pada dua janin dari bendungan tunggal. Paparan metformin dalam setiap kombinasi adalah 4 kali paparan manusia 2000 mg setiap hari.
Saxagliptin diberikan pada tikus betina dari hari kehamilan 6 sampai hari laktasi 20 yang mengakibatkan penurunan berat badan pada pria dan wanita. anak perempuan hanya pada dosis toksik maternal (paparan â ‰ ¥ 1629 dan 53 kali saxagliptin dan metabolit aktifnya di MRHD). Tidak ada toksisitas fungsional atau perilaku yang diamati pada keturunan tikus yang diberikan saxagliptin pada dosis berapa pun.
Saxagliptin melintasi plasenta ke janin setelah pemberian dosis pada tikus hamil.
Menyusui Ibu
Saxagliptin disekresi dalam susu tikus menyusui dengan perbandingan sekitar 1: 1 dengan konsentrasi obat dalam plasma. Tidak diketahui apakah saxagliptin dikeluarkan dalam ASI. Karena banyak obat dikeluarkan dalam ASI, kehati-hatian harus dilakukan ketika Onglyza diberikan kepada wanita menyusui.
Penggunaan Pediatrik
Keamanan dan efektivitas Onglyza pada pasien anak belum ditetapkan.
Penggunaan Geriatri
Dalam enam, uji klinis double-blind, terkontrol keamanan dan kemanjuran Onglyza, 634 (15,3%) dari 4148 pasien acak adalah 65 tahun ke atas, dan 59 (1,4%) pasien berusia 75 tahun ke atas. Tidak ada perbedaan keseluruhan dalam keamanan atau efektivitas yang diamati antara pasien berusia 65 tahun dan pasien yang lebih muda. Sementara pengalaman klinis ini belum mengidentifikasi perbedaan dalam tanggapan antara pasien lansia dan pasien yang lebih muda, sensitivitas yang lebih besar dari beberapa individu yang lebih tua tidak dapat dikesampingkan.
Saxagliptin dan metabolit aktifnya sebagian dieliminasi oleh ginjal. Karena pasien usia lanjut lebih cenderung mengalami penurunan fungsi ginjal, perawatan harus diambil dalam pemilihan dosis pada lansia berdasarkan fungsi ginjal. [Lihat Dosis dan Administrasi, Pasien dengan Gangguan Ginjal dan Farmakologi Klinis, Farmakokinetik.]
teratas
Overdosis
Dalam uji klinis terkontrol, Onglyza sekali sehari, diberikan secara oral pada subyek sehat dengan dosis hingga 400 mg setiap hari selama 2 minggu (80 kali MRHD) tidak memiliki efek samping klinis terkait dosis dan tidak ada efek klinis yang bermakna pada interval QTc atau jantung menilai.
Jika terjadi overdosis, pengobatan suportif yang sesuai harus dimulai sebagaimana ditentukan oleh status klinis pasien. Saxagliptin dan metabolit aktifnya dihilangkan dengan hemodialisis (23% dari dosis lebih dari 4 jam).
teratas
Deskripsi
Saxagliptin adalah penghambat aktif enzim DPP4 secara oral.
Saxagliptin monohydrate dijelaskan secara kimiawi sebagai (1S, 3S, 5S) -2 - [(2S) -2-Amino-2- (3-hydroxytricyclo [3.3.1.13,7] dec-1-yl) asetil] -2-azabicyclo [3.1.0] hexane-3-carbonitrile, monohydrate atau (1S, 3S, 5S) - 2 - [(2S) - 2 - Amino - 2 - (3 - hydroxyadamantan - 1 - yl) asetil] - 2 - azabicyclo [3.1.0] hexane - 3 - carbonitrile hidrat. Rumus empiris adalah C18H25N3HAI2-H2O dan berat molekul adalah 333,43. Rumus struktural adalah:
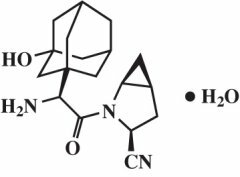
Saxagliptin monohydrate adalah bubuk kristal berwarna putih sampai kuning atau coklat muda, non-higroskopis. Ini sedikit larut dalam air pada 24 ° C ± 3 ° C, sedikit larut dalam etil asetat, dan larut dalam metanol, etanol, isopropil alkohol, asetonitril, aseton, dan polietilen glikol 400 (PEG 400).
Setiap tablet berlapis film Onglyza untuk penggunaan oral mengandung 2,79 mg saxagliptin hidroklorida (anhidrat) setara dengan 2,5 mg saxagliptin atau 5,58 mg saxagliptin hidroklorida (anhidrat) setara dengan 5 mg saxagliptin dan bahan-bahan tidak aktif berikut: laktosa monohidrat, selulosa mikrokristalin, natrium croscarmellose, dan magnesium Stearate. Selain itu, lapisan film mengandung bahan-bahan tidak aktif berikut: polivinil alkohol, polietilen glikol, titanium dioksida, bedak, dan oksida besi.
teratas
Farmakologi Klinis
Mekanisme aksi
Peningkatan konsentrasi hormon incretin seperti glucagon-like peptide-1 (GLP-1) dan glukosa-dependent insulinotropic polypeptide (GIP) dilepaskan ke dalam aliran darah dari usus kecil sebagai respons makanan Hormon-hormon ini menyebabkan pelepasan insulin dari sel beta pankreas dengan cara yang bergantung pada glukosa tetapi tidak diaktifkan oleh enzim dipeptidyl peptidase-4 (DPP4) dalam beberapa menit. GLP-1 juga menurunkan sekresi glukagon dari sel alpha pankreas, mengurangi produksi glukosa hati. Pada pasien dengan diabetes tipe 2, konsentrasi GLP-1 berkurang tetapi respon insulin terhadap GLP-1 dipertahankan. Saxagliptin adalah inhibitor DPP4 kompetitif yang memperlambat inaktivasi hormon incretin, sehingga meningkatkan aliran darah mereka konsentrasi dan mengurangi konsentrasi glukosa puasa dan postprandial tergantung pada glukosa pada pasien dengan diabetes tipe 2 mellitus.
Farmakodinamik
Pada pasien dengan diabetes mellitus tipe 2, pemberian Onglyza menghambat aktivitas enzim DPP4 selama 24 jam. Setelah muatan glukosa oral atau makan, penghambatan DPP4 ini menghasilkan peningkatan 2 sampai 3 kali lipat dalam tingkat sirkulasi aktif GLP-1 dan GIP, penurunan konsentrasi glukagon, dan peningkatan sekresi insulin yang bergantung glukosa dari sel beta pankreas. Peningkatan insulin dan penurunan glukagon dikaitkan dengan konsentrasi glukosa puasa yang lebih rendah dan berkurangnya perjalanan glukosa setelah beban glukosa oral atau makan.
Elektrofisiologi Jantung
Dalam studi komparator aktif acak, tersamar ganda, terkontrol plasebo, 4 arah, menggunakan moxifloxacin pada 40 subyek sehat, Onglyza tidak dikaitkan dengan perpanjangan yang bermakna secara klinis dari interval QTc atau denyut jantung pada dosis harian hingga 40 mg (8 kali lipat dari MRHD).
Farmakokinetik
Farmakokinetik saxagliptin dan metabolit aktifnya, 5-hydroxy saxagliptin serupa pada subjek sehat dan pada pasien dengan diabetes mellitus tipe 2. Cmaks dan nilai-nilai AUC dari saxagliptin dan metabolit aktifnya meningkat secara proporsional dalam kisaran dosis 2,5 hingga 400 mg. Setelah pemberian saxagliptin dosis tunggal 5 mg oral pada subyek sehat, nilai rata-rata AUC plasma untuk saxagliptin dan metabolit aktifnya masing-masing adalah 78 ng-h / mL dan 214 ng-h / mL. Plasma yang sesuai Cmaks nilainya masing-masing 24 ng / mL dan 47 ng / mL. Variabilitas rata-rata (% CV) untuk AUC dan Cmaks untuk saxagliptin dan metabolit aktifnya kurang dari 25%.
Tidak ada akumulasi yang cukup dari saxagliptin atau metabolit aktifnya yang diamati dengan dosis sekali sehari yang diulang pada tingkat dosis apa pun. Tidak ada dosis dan ketergantungan waktu yang diamati dalam pembersihan saxagliptin dan metabolit aktifnya selama 14 hari dosis sekali sehari dengan saxagliptin pada dosis mulai dari 2,5 hingga 400 mg.
Penyerapan
Waktu rata-rata untuk konsentrasi maksimum (Tmaks) mengikuti dosis 5 mg sehari sekali adalah 2 jam untuk saxagliptin dan 4 jam untuk metabolit aktifnya. Administrasi dengan makanan tinggi lemak menghasilkan peningkatan Tmaks dari saxagliptin sekitar 20 menit dibandingkan dengan kondisi puasa. Ada peningkatan 27% dalam AUC dari saxagliptin ketika diberikan dengan makanan dibandingkan dengan kondisi puasa. Onglyza dapat diberikan dengan atau tanpa makanan.
Distribusi
Ikatan protein in vitro saxagliptin dan metabolit aktifnya dalam serum manusia dapat diabaikan. Oleh karena itu, perubahan kadar protein darah di berbagai keadaan penyakit (mis., Gangguan ginjal atau hati) tidak diharapkan untuk mengubah disposisi saxagliptin.
Metabolisme
Metabolisme saxagliptin terutama dimediasi oleh sitokrom P450 3A4 / 5 (CYP3A4 / 5). Metabolit utama saxagliptin juga merupakan inhibitor DPP4, yang setengahnya sama kuatnya dengan saxagliptin. Oleh karena itu, penghambat dan penginduksi CYP3A4 / 5 yang kuat akan mengubah farmakokinetik saxagliptin dan metabolit aktifnya. [Lihat Interaksi obat.]
Pengeluaran
Saxagliptin dihilangkan oleh jalur ginjal dan hati. Mengikuti dosis tunggal 50 mg 14C-saxagliptin, 24%, 36%, dan 75% dari dosis diekskresikan dalam urin sebagai saxagliptin, metabolit aktifnya, dan total radioaktivitas, masing-masing. Rata-rata pembersihan ginjal saxagliptin (~ 230 mL / mnt) lebih besar dari perkiraan laju filtrasi glomerulus rata-rata (~ 120 mL / mnt), menunjukkan beberapa ekskresi ginjal aktif. Sebanyak 22% dari radioaktivitas yang diberikan ditemukan dalam tinja yang mewakili fraksi dosis saxagliptin yang diekskresikan dalam empedu dan / atau obat yang tidak diserap dari saluran pencernaan. Setelah dosis oral tunggal Onglyza 5 mg untuk subyek sehat, rata-rata paruh plasma terminal (t1/2) untuk saxagliptin dan metabolit aktifnya masing-masing adalah 2,5 dan 3,1 jam.
Populasi spesifik
Gangguan ginjal
Sebuah studi label terbuka dosis tunggal dilakukan untuk mengevaluasi farmakokinetik saxagliptin (dosis 10 mg) dalam subyek dengan berbagai tingkat kerusakan ginjal kronis (N = 8 per kelompok) dibandingkan dengan subyek dengan ginjal normal fungsi. Studi ini termasuk pasien dengan gangguan ginjal yang diklasifikasikan berdasarkan bersihan kreatinin sebagai ringan (> 50 hingga ‰ ‰80 mL / min), sedang (30 hingga ‰ ¤50 mL / mnt), dan berat (<30 mL / mnt), serta pasien dengan penyakit ginjal tahap akhir yang sedang hemodialisis. Izin kreatinin diperkirakan dari kreatinin serum berdasarkan rumus Cockcroft-Gault:
CrCl = [140 ˆ usia (tahun)] × berat (kg) {× 0,85 untuk pasien wanita}
[72 × kreatinin serum (mg / dL)]
Tingkat kerusakan ginjal tidak mempengaruhi Cmaks dari saxagliptin atau metabolit aktifnya. Pada subjek dengan gangguan ginjal ringan, nilai AUC dari saxagliptin dan metabolit aktifnya masing-masing adalah 20% dan 70% lebih tinggi daripada nilai AUC pada subjek dengan fungsi ginjal normal. Karena peningkatan besarnya ini tidak dianggap relevan secara klinis, penyesuaian dosis pada pasien dengan gangguan ginjal ringan tidak dianjurkan. Pada subjek dengan gangguan ginjal sedang atau berat, nilai AUC dari saxagliptin dan aktifnya metabolit masing-masing mencapai 2,1 dan 4,5 kali lipat lebih tinggi daripada nilai AUC pada subjek dengan ginjal normal fungsi. Untuk mencapai paparan plasma saxagliptin dan metabolit aktifnya serupa dengan pasien dengan fungsi ginjal normal, dosis yang dianjurkan adalah 2,5 mg sekali sehari pada pasien dengan gangguan ginjal sedang dan berat, serta pada pasien dengan penyakit ginjal stadium akhir yang membutuhkan hemodialisis. Saxagliptin dihilangkan dengan hemodialisis.
Ggn hati
Pada subjek dengan gangguan hati (kelas Child-Pugh A, B, dan C), berarti Cmaks dan AUC saxagliptin masing-masing hingga 8% dan 77% lebih tinggi, dibandingkan dengan kontrol yang sehat setelah pemberian dosis tunggal saxagliptin 10 mg. C yang sesuaimaks dan AUC dari metabolit aktif masing-masing hingga 59% dan 33% lebih rendah, dibandingkan dengan kontrol yang sehat. Perbedaan-perbedaan ini tidak dianggap bermakna secara klinis. Tidak ada penyesuaian dosis yang dianjurkan untuk pasien dengan gangguan hati.
Indeks massa tubuh
Tidak ada penyesuaian dosis yang direkomendasikan berdasarkan indeks massa tubuh (BMI) yang tidak diidentifikasi sebagai signifikan kovariat pada pembersihan nyata saxagliptin atau metabolit aktifnya dalam farmakokinetik populasi analisis.
Jenis kelamin
Tidak ada penyesuaian dosis yang dianjurkan berdasarkan jenis kelamin. Tidak ada perbedaan yang diamati dalam farmakokinetik saxagliptin antara pria dan wanita. Dibandingkan dengan pria, wanita memiliki nilai paparan sekitar 25% lebih tinggi untuk metabolit aktif daripada pria, tetapi perbedaan ini tidak mungkin memiliki relevansi klinis. Jenis kelamin tidak diidentifikasi sebagai kovariat yang signifikan pada pembersihan jelas saxagliptin dan metabolit aktifnya dalam analisis farmakokinetik populasi.
Geriatrik
Tidak ada penyesuaian dosis yang dianjurkan berdasarkan usia saja. Subjek lansia (65-80 tahun) memiliki rata-rata geometrik C 23% dan 59% lebih tinggimaks dan nilai rata-rata AUC geometris, masing-masing, untuk saxagliptin daripada subjek muda (18-40 tahun). Perbedaan farmakokinetik metabolit aktif antara orang tua dan anak muda umumnya mencerminkan perbedaan yang diamati dalam farmakokinetik saxagliptin. Perbedaan antara farmakokinetik saxagliptin dan metabolit aktif pada usia muda dan lanjut usia subyek kemungkinan karena beberapa faktor termasuk penurunan fungsi ginjal dan kapasitas metabolisme bertambahnya usia. Usia tidak diidentifikasi sebagai kovariat yang signifikan pada pembersihan jelas saxagliptin dan metabolit aktifnya dalam populasi analisis farmakokinetik
Pediatrik
Studi yang mengkarakterisasi farmakokinetik saxagliptin pada pasien anak belum dilakukan.
Ras dan Etnis
Tidak ada penyesuaian dosis yang dianjurkan berdasarkan ras. Analisis farmakokinetik populasi membandingkan farmakokinetik saxagliptin dan aktifnya metabolit pada 309 subjek Kaukasia dengan 105 subjek non-Kaukasia (terdiri dari enam ras grup). Tidak ada perbedaan signifikan dalam farmakokinetik saxagliptin dan metabolit aktifnya yang terdeteksi antara kedua populasi ini.
Interaksi Obat-Obat
Penilaian In Vitro Interaksi Obat
Metabolisme saxagliptin terutama dimediasi oleh CYP3A4 / 5.
Dalam studi in vitro, saxagliptin dan metabolit aktifnya tidak menghambat CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1, atau 3A4, atau menginduksi CYP1A2, 2B6, 2C9, atau 3A4. Oleh karena itu, saxagliptin tidak diharapkan untuk mengubah pembersihan metabolik dari obat yang diberikan bersama yang dimetabolisme oleh enzim ini. Saxagliptin adalah substrat P-glikoprotein (P-gp) tetapi bukan penghambat atau penginduksi P-gp yang signifikan.
Ikatan protein in vitro saxagliptin dan metabolit aktifnya dalam serum manusia dapat diabaikan. Dengan demikian, pengikatan protein tidak akan memiliki pengaruh yang berarti pada farmakokinetik saxagliptin atau obat lain.
Dalam Penilaian Vivo Interaksi Obat
Efek Saxagliptin pada Obat Lain
Dalam studi yang dilakukan pada subyek sehat, seperti yang dijelaskan di bawah ini, saxagliptin tidak bermakna mengubah farmakokinetik dari metformin, glyburide, pioglitazone, digoxin, simvastatin, diltiazem, atau ketoconazole.
Metformin: Pemberian dosis tunggal saxagliptin (100 mg) dan metformin (1000 mg), substrat hOCT-2 dosis tunggal, tidak mengubah farmakokinetik metformin pada subjek sehat. Oleh karena itu, Onglyza bukan penghambat transportasi yang dimediasi hOCT-2.
Glyburide: Pemberian bersama dosis tunggal saxagliptin (10 mg) dan glyburide (5 mg), substrat CYP2C9, meningkatkan plasma Cmaks glyburide sebesar 16%; Namun, AUC dari glyburide tidak berubah. Oleh karena itu, Onglyza tidak secara bermakna menghambat metabolisme yang dimediasi CYP2C9.
Pioglitazone: Pemberian bersama beberapa kali sehari dosis saxagliptin (10 mg) dan pioglitazone (45 mg), substrat CYP2C8, meningkatkan plasma Cmaks dari pioglitazone sebesar 14%; Namun, AUC pioglitazone tidak berubah.
Digoxin: Pemberian bersama beberapa kali sehari dosis saxagliptin (10 mg) dan digoxin (0,25 mg), substrat P-gp, tidak mengubah farmakokinetik dari digoxin. Oleh karena itu, Onglyza bukan penghambat atau penginduksi transportasi yang dimediasi P-gp.
Simvastatin: Pemberian bersama beberapa kali sehari dosis saxagliptin (10 mg) dan simvastatin (40 mg), substrat CYP3A4 / 5, tidak mengubah farmakokinetik simvastatin. Oleh karena itu, Onglyza bukan inhibitor atau induser metabolisme CYP3A4 / 5-dimediasi.
Diltiazem: Pemberian bersama beberapa kali sehari dosis saxagliptin (10 mg) dan diltiazem (formulasi kerja panjang 360 mg pada kondisi tunak), suatu penghambat moderat CYP3A4 / 5, meningkatkan plasma Cmaks dari diltiazem sebesar 16%; Namun, AUC dari diltiazem tidak berubah.
Ketoconazole: Pemberian dosis tunggal saxagliptin (100 mg) dan berbagai dosis ketoconazole (200 mg setiap 12 jam di steady state), inhibitor kuat CYP3A4 / 5 dan P-gp, menurunkan Cmax plasma dan AUC dari ketoconazole sebesar 16% dan 13%, masing-masing.
Efek Obat Lain pada Saxagliptin
Metformin: Pemberian dosis tunggal saxagliptin (100 mg) dan metformin (1000 mg), substrat hOCT-2 dosis tunggal, menurunkan Cmaks dari saxagliptin sebesar 21%; Namun, AUC tidak berubah.
Glyburide: Pemberian bersama dosis tunggal saxagliptin (10 mg) dan glburide (5 mg), substrat CYP2C9, meningkatkan Cmaks dari saxagliptin sebesar 8%; Namun, AUC dari saxagliptin tidak berubah.
Pioglitazone: Pemberian bersama beberapa kali sehari dosis saxagliptin (10 mg) dan pioglitazone (45 mg), substrat CYP2C8 (utama) dan CYP3A4 (minor), tidak mengubah farmakokinetik dari saxagliptin.
Digoxin: Pemberian bersama beberapa kali sehari dosis saxagliptin (10 mg) dan digoxin (0,25 mg), substrat P-gp, tidak mengubah farmakokinetik saxagliptin.
Simvastatin: Pemberian bersama beberapa kali sehari dosis saxagliptin (10 mg) dan simvastatin (40 mg), substrat CYP3A4 / 5, meningkatkan Cmaks dari saxagliptin sebesar 21%; Namun, AUC dari saxagliptin tidak berubah.
Diltiazem: Pemberian dosis tunggal saxagliptin (10 mg) dan diltiazem (formulasi kerja panjang 360 mg pada kondisi tunak), suatu inhibitor moderat CYP3A4 / 5, meningkatkan Cmaks dari saxagliptin sebesar 63% dan AUC sebesar 2,1 kali lipat. Ini dikaitkan dengan penurunan C yang sesuaimaks dan AUC dari metabolit aktif masing-masing sebesar 44% dan 36%.
Ketoconazole: Pemberian dosis tunggal saxagliptin (100 mg) dan ketoconazole (200 mg setiap 12 jam pada kondisi tunak), penghambat kuat CYP3A4 / 5 dan P-gp, meningkatkan Cmaks untuk saxagliptin sebesar 62% dan AUC sebesar 2,5 kali lipat. Ini dikaitkan dengan penurunan C yang sesuaimaks dan AUC dari metabolit aktif masing-masing sebesar 95% dan 91%.
Dalam penelitian lain, pemberian dosis tunggal saxagliptin (20 mg) dan ketoconazole (200 mg setiap 12 jam pada kondisi tunak), meningkatkan Cmaks dan AUC dari saxagliptin masing-masing sebesar 2,4 kali lipat dan 3,7 kali lipat. Ini dikaitkan dengan penurunan C yang sesuaimaks dan AUC dari metabolit aktif masing-masing 96% dan 90%.
Rifampin: Pemberian dosis tunggal saxagliptin (5 mg) dan rifampin (600 mg QD dosis tunggal pada kondisi tunak) menurunkan Cmaks dan AUC dari saxagliptin masing-masing sebesar 53% dan 76%, dengan peningkatan yang sesuai dalam Cmaks (39%) tetapi tidak ada perubahan signifikan dalam AUC plasma dari metabolit aktif.
Omeprazole: Pemberian bersama beberapa kali sehari dosis saxagliptin (10 mg) dan omeprazole (40 mg), sebuah CYP2C19 (utama) dan substrat CYP3A4, penghambat CYP2C19, dan induser MRP-3, tidak mengubah farmakokinetik dari saxagliptin.
Aluminium hidroksida + magnesium hidroksida + simetikon: Pemberian dosis tunggal saxagliptin (10 mg) dan cairan yang mengandung aluminium hidroksida (2400 mg), magnesium hidroksida (2400 mg), dan simetikon (240 mg) menurunkan Cmaks dari saxagliptin sebesar 26%; Namun, AUC dari saxagliptin tidak berubah.
Famotidine: Pemberian dosis tunggal saxagliptin (10 mg) 3 jam setelah dosis tunggal famotidine (40 mg), inhibitor hOCT-1, hOCT-2, dan hOCT-3, meningkatkan Cmaks dari saxagliptin sebesar 14%; Namun, AUC dari saxagliptin tidak berubah.
teratas
Toksikologi Nonklinis
Karsinogenesis, Mutagenesis, Penurunan Kesuburan
Saxagliptin tidak menginduksi tumor pada tikus (50, 250, dan 600 mg / kg) atau tikus (25, 75, 150, dan 300 mg / kg) pada dosis tertinggi yang dievaluasi. Dosis tertinggi yang dievaluasi pada tikus setara dengan sekitar 870 (pria) dan 1165 (wanita) kali paparan manusia di MRHD 5 mg / hari. Pada tikus, paparan sekitar 355 (pria) dan 2217 (wanita) kali MRHD.
Saxagliptin tidak bersifat mutagenik atau klastogenik dengan atau tanpa aktivasi metabolik dalam uji bakteri Ames in vitro, uji sitogenetika in vitro pada manusia primer limfosit, uji mikronukleus oral in vivo pada tikus, studi perbaikan DNA oral in vivo pada tikus, dan studi sitogenetika in vivo / in vitro oral dalam darah tepi tikus limfosit. Metabolit aktif tidak bersifat mutagenik dalam uji bakteri Ames in vitro.
Dalam studi kesuburan tikus, pejantan diperlakukan dengan dosis oral gavage selama 2 minggu sebelum kawin, selama kawin, dan hingga jadwal yang dijadwalkan. terminasi (kira-kira total 4 minggu) dan wanita diobati dengan dosis oral oral selama 2 minggu sebelum kawin sampai usia kehamilan hari ke 7. Tidak ada efek buruk pada kesuburan yang diamati pada paparan sekitar 603 (pria) dan 776 (wanita) kali MRHD. Dosis yang lebih tinggi yang menimbulkan toksisitas ibu juga meningkatkan resorpsi janin (sekitar 2069 dan 6138 kali MRHD). Efek tambahan pada siklus estrus, kesuburan, ovulasi, dan implantasi diamati sekitar 6138 kali MRHD.
Toksikologi Hewan
Saxagliptin menghasilkan perubahan kulit yang merugikan pada ekstremitas monyet cynomolgus (keropeng dan / atau ulserasi pada ekor, jari, skrotum, dan / atau hidung). Lesi kulit bersifat reversibel pada 20 ½ kali MRHD tetapi dalam beberapa kasus bersifat ireversibel dan nekrotikan pada pajanan yang lebih tinggi. Perubahan kulit yang merugikan tidak diamati pada paparan yang mirip dengan (1 sampai 3 kali) MRHD 5 mg. Korelasi klinis dengan lesi kulit pada monyet belum diamati dalam uji klinis manusia terhadap saxagliptin.
teratas
Studi Klinis
Onglyza telah dipelajari sebagai monoterapi dan dalam kombinasi dengan terapi metformin, glyburide, dan thiazolidinedione (pioglitazone dan rosiglitazone). Onglyza belum diteliti dalam kombinasi dengan insulin.
Sebanyak 4148 pasien dengan diabetes mellitus tipe 2 diacak dalam enam, uji klinis ganda-terkontrol yang dilakukan untuk mengevaluasi keamanan dan kemanjuran glikemik Onglyza. Sebanyak 3.021 pasien dalam uji coba ini diobati dengan Onglyza. Dalam uji coba ini, usia rata-rata adalah 54 tahun, dan 71% pasien Kaukasia, 16% Asia, 4% berkulit hitam, dan 9% dari kelompok ras lain. 423 pasien tambahan, termasuk 315 yang menerima Onglyza, berpartisipasi dalam studi yang dikendalikan dengan plasebo, dengan rentang dosis 6 hingga 12 minggu dalam durasi.
Dalam enam percobaan double-blind ini, Onglyza dievaluasi dengan dosis 2,5 mg dan 5 mg sekali sehari. Tiga dari percobaan ini juga mengevaluasi dosis saxagliptin 10 mg setiap hari. Dosis saxagliptin 10 mg setiap hari tidak memberikan kemanjuran yang lebih besar daripada dosis harian 5 mg. Pengobatan dengan Onglyza pada semua dosis menghasilkan peningkatan klinis yang relevan secara statistik dan signifikan dalam hemoglobin A1c (A1C), glukosa plasma puasa (FPG), dan glukosa postprandial 2 jam (PPG) setelah tes toleransi glukosa oral (OGTT) standar, dibandingkan dengan kontrol. Penurunan A1C terlihat di seluruh subkelompok termasuk jenis kelamin, usia, ras, dan IMT awal.
Onglyza tidak dikaitkan dengan perubahan signifikan dari awal dalam berat badan atau lipid serum puasa dibandingkan dengan plasebo.
Monoterapi
Sebanyak 766 pasien dengan diabetes tipe 2 tidak cukup terkontrol pada diet dan olahraga (A1C ‰ ¥ 7% hingga ‰ ¤10%) berpartisipasi dalam dua percobaan 24 minggu, double-blind, terkontrol plasebo mengevaluasi kemanjuran dan keamanan Onglyza monoterapi.
Dalam percobaan pertama, setelah 2 minggu diet tunggal, olahraga, dan periode plasebo, 401 pasien diacak menjadi 2,5 mg, 5 mg, atau 10 mg Onglyza atau plasebo. Pasien yang gagal memenuhi tujuan glikemik spesifik selama penelitian dirawat dengan terapi penyelamatan metformin, ditambahkan ke plasebo atau Onglyza. Kemanjuran dievaluasi pada pengukuran terakhir sebelum terapi penyelamatan untuk pasien yang membutuhkan penyelamatan. Titrasi dosis Onglyza tidak diizinkan.
Pengobatan dengan Onglyza 2,5 mg dan 5 mg setiap hari memberikan peningkatan signifikan pada A1C, FPG, dan PPG dibandingkan dengan plasebo (Tabel 3). Persentase pasien yang berhenti karena kurangnya kontrol glikemik atau yang diselamatkan untuk pertemuan yang ditentukan sebelumnya kriteria glikemik adalah 16% pada kelompok pengobatan Onglyza 2,5 mg, 20% pada kelompok pengobatan Onglyza 5 mg, dan 26% pada kelompok kelompok plasebo.
Tabel 3: Parameter Glikememik pada Minggu ke 24 dalam Studi yang Dikontrol Plasebo dari Onglyza Monoterapi pada Pasien dengan Diabetes Tipe 2 *
| Parameter kemanjuran | Onglyza 2,5 mg N = 102 |
Onglyza 5 mg N = 106 |
Placebo N = 95 |
|---|---|---|---|
| * Populasi yang ingin diobati menggunakan pengamatan terakhir pada penelitian atau pengamatan terakhir sebelum terapi penyelamatan metformin untuk pasien yang membutuhkan penyelamatan. | |||
| †Kuadrat terkecil berarti disesuaikan dengan nilai awal. | |||
| c p-value <0,0001 dibandingkan dengan plasebo | |||
| § p-value <0,05 dibandingkan dengan plasebo | |||
| ¶ Signifikansi tidak diuji untuk PPG 2 jam untuk dosis Onglyza 2,5 mg. | |||
| Hemoglobin A1C (%) | N = 100 | N = 103 | N = 92 |
| Baseline (rata-rata) | 7.9 | 8.0 | 7.9 |
| Ubah dari baseline (rata-rata yang disesuaikan†) | −0.4 | −0.5 | +0.2 |
| Perbedaan dari plasebo (rata-rata yang disesuaikan†) | −0.6c | −0.6c | |
| Interval Keyakinan 95% | (−0.9, −0.3) | (−0.9, −0.4) | |
| Persen pasien yang mencapai A1C <7% | 35% (35/100) | 38% §(39/103) | 24% (22/92) |
| Glukosa Plasma Puasa (mg / dL) | N = 101 | N = 105 | N = 92 |
| Baseline (rata-rata) | 178 | 171 | 172 |
| Ubah dari baseline (rata-rata yang disesuaikan†) | −15 | −9 | +6 |
| Perbedaan dari plasebo (rata-rata yang disesuaikan†) | −21 § | −15 § | |
| Interval Keyakinan 95% | (−31, −10) | (−25, −4) | |
| 2 jam Postprandial Glucose (mg / dL) | N = 78 | N = 84 | N = 71 |
| Baseline (rata-rata) | 279 | 278 | 283 |
| Ubah dari baseline (rata-rata yang disesuaikan†) | −45 | −43 | −6 |
| Perbedaan dari plasebo (rata-rata yang disesuaikan†) | −39 ¶ | −37 § | |
| Interval Keyakinan 95% | (−61, −16) | (−59, −15) |
Percobaan monoterapi 24 minggu kedua dilakukan untuk menilai berbagai rejimen dosis untuk Onglyza. Pasien naif pengobatan dengan diabetes yang tidak terkontrol secara memadai (A1C - 7% hingga 7% - 10%) menjalani 2 minggu, diet satu mata, olahraga, dan periode sebelum plasebo. Sebanyak 365 pasien diacak menjadi 2,5 mg setiap pagi, 5 mg setiap pagi, 2,5 mg dengan kemungkinan titrasi hingga 5 mg setiap pagi, atau 5 mg setiap malam Onglyza, atau plasebo. Pasien yang gagal memenuhi tujuan glikemik spesifik selama penelitian diobati dengan terapi penyelamatan metformin yang ditambahkan ke plasebo atau Onglyza; jumlah pasien secara acak per kelompok perlakuan berkisar 71-74.
Pengobatan dengan Onglyza 5 mg setiap pagi atau 5 mg setiap malam memberikan peningkatan yang signifikan dalam A1C dibandingkan dengan plasebo (pengurangan rata-rata yang dikoreksi plasebo masing-masing adalah '0,4% dan '0,3%). Pengobatan dengan Onglyza 2,5 mg setiap pagi juga memberikan peningkatan yang signifikan pada A1C dibandingkan dengan plasebo (pengurangan rata-rata yang terkoreksi-plasebo dari â € .40,4%).
Terapi Kombinasi
Terapi Kombinasi Tambahan dengan Metformin
Sebanyak 743 pasien dengan diabetes tipe 2 berpartisipasi dalam uji coba terkontrol plasebo terkontrol plasebo selama 24 minggu untuk mengevaluasi kemanjuran dan keamanan Onglyza dalam kombinasi dengan metformin pada pasien dengan kontrol glikemik yang tidak adekuat (A1C - ¥ 7% dan - 10%) pada metformin sendirian. Untuk memenuhi syarat untuk pendaftaran, pasien diminta untuk menggunakan metformin dosis stabil (1500-2550 mg setiap hari) selama minimal 8 minggu.
Pasien yang memenuhi kriteria kelayakan terdaftar dalam studi single-blind, 2 minggu, diet dan latihan placebo periode di mana pasien menerima metformin pada dosis pra-studi mereka, hingga 2500 mg setiap hari, selama durasi belajar. Setelah periode awal, pasien yang memenuhi syarat secara acak menjadi 2,5 mg, 5 mg, atau 10 mg Onglyza atau plasebo di samping dosis saat ini dari metformin label terbuka. Pasien yang gagal memenuhi tujuan glikemik spesifik selama penelitian dirawat dengan terapi penyelamatan pioglitazone, ditambahkan ke obat studi yang ada. Titrasi dosis Onglyza dan metformin tidak diizinkan.
Onglyza 2,5 mg dan 5 mg add-on untuk meformin memberikan peningkatan signifikan pada A1C, FPG, dan PPG dibandingkan dengan plasebo add-on untuk metformin (Tabel 4). Perubahan rata-rata dari awal untuk A1C dari waktu ke waktu dan pada titik akhir ditunjukkan pada Gambar 1. Proporsi pasien yang berhenti karena kurangnya kontrol glikemik atau yang diselamatkan untuk memenuhi kriteria glikemik yang ditentukan sebelumnya adalah 15% di Onglyza 2,5 mg add-on ke grup metformin, 13% di add on onglyza 5 mg ke grup metformin, dan 27% di add-on placebo untuk metformin kelompok.
Tabel 4: Parameter Glikememik pada Minggu ke 24 dalam Studi Onglyza yang Dikontrol Plasebo sebagai Terapi Kombinasi Tambahan dengan Metformin *
| Parameter kemanjuran | Onglyza 2,5 mg + Metformin N = 192 |
Onglyza 5 mg + Metformin N = 191 |
Placebo + Metformin N = 179 |
|---|---|---|---|
| * Populasi yang ingin diobati menggunakan pengamatan terakhir pada penelitian atau pengamatan terakhir sebelum terapi penyelamatan pioglitazone untuk pasien yang membutuhkan penyelamatan. | |||
| †Kuadrat terkecil berarti disesuaikan dengan nilai awal. | |||
| c p-value <0,0001 dibandingkan dengan plasebo + metformin | |||
| § nilai p <0,05 dibandingkan dengan plasebo + metformin | |||
| Hemoglobin A1C (%) | N = 186 | N = 186 | N = 175 |
| Baseline (rata-rata) | 8.1 | 8.1 | 8.1 |
| Ubah dari baseline (rata-rata yang disesuaikan†) | −0.6 | −0.7 | +0.1 |
| Perbedaan dari plasebo (rata-rata yang disesuaikan†) | −0.7c | −0.8c | |
| Interval Keyakinan 95% | (−0.9, −0.5) | (−1.0, −0.6) | |
| Persen pasien yang mencapai A1C <7% | 37% §(69/186) | 44% §(81/186) | 17% (29/175) |
| Glukosa Plasma Puasa (mg / dL) | N = 188 | N = 187 | N = 176 |
| Baseline (rata-rata) | 174 | 179 | 175 |
| Ubah dari baseline (rata-rata yang disesuaikan†) | −14 | −22 | +1 |
| Perbedaan dari plasebo (rata-rata yang disesuaikan†) | −16 § | −23 § | |
| Interval Keyakinan 95% | (−23, −9) | (−30, −16) | |
| 2 jam Postprandial Glucose (mg / dL) | N = 155 | N = 155 | N = 135 |
| Baseline (rata-rata) | 294 | 296 | 295 |
| Ubah dari baseline (rata-rata yang disesuaikan†) | −62 | −58 | −18 |
| Perbedaan dari plasebo (rata-rata yang disesuaikan†) | −44 § | −40 § | |
| Interval Keyakinan 95% | (−60, −27) | (−56, −24) |
Gambar 1: Perubahan Rata-rata dari Baseline pada A1C dalam Uji Coba Onglyza yang Dikontrol-placebo sebagai Terapi Kombinasi Add-On dengan Metformin *

* Termasuk pasien dengan nilai awal dan 24 minggu.
Minggu 24 (LOCF) termasuk populasi yang ingin diobati menggunakan pengamatan terakhir pada studi sebelum terapi penyelamatan pioglitazone untuk pasien yang membutuhkan penyelamatan. Perubahan rata-rata dari awal disesuaikan untuk nilai dasar.
Terapi Kombinasi Add-On dengan Thiazolidinedione
Sebanyak 565 pasien dengan diabetes tipe 2 berpartisipasi dalam uji coba terkontrol plasebo terkontrol plasebo selama 24 minggu untuk mengevaluasi kemanjuran dan keamanan Onglyza dalam kombinasi dengan thiazolidinedione (TZD) pada pasien dengan kontrol glikemik yang tidak adekuat (A1C ‰ ¥ 7% hingga ‰ ¤10,5%) pada TZD sendiri. Untuk memenuhi syarat untuk pendaftaran, pasien diminta untuk menggunakan pioglitazone dosis stabil (30-45 mg sekali sehari) atau rosiglitazone (4 mg sekali sehari atau 8 mg baik sekali sehari atau dalam dua dosis terbagi 4 mg) untuk paling sedikit 12 minggu.
Pasien yang memenuhi kriteria kelayakan terdaftar dalam diet tunggal-buta, 2 minggu, dan olahraga plasebo dalam periode di mana pasien menerima TZD pada dosis pra-studi mereka selama durasi belajar. Setelah periode awal, pasien yang memenuhi syarat secara acak menjadi 2,5 mg atau 5 mg Onglyza atau plasebo di samping dosis TZD mereka saat ini. Pasien yang gagal memenuhi tujuan glikemik spesifik selama penelitian dirawat dengan penyelamatan metformin, ditambahkan ke obat studi yang ada. Titrasi dosis Onglyza atau TZD tidak diizinkan selama penelitian. Suatu perubahan dalam rejimen TZD dari rosiglitazone ke pioglitazone pada dosis terapi yang setara dan setara diizinkan berdasarkan kebijaksanaan peneliti jika diyakini secara medis sesuai.
Onglyza 2,5 mg dan 5 mg add-on untuk TZD memberikan peningkatan signifikan pada A1C, FPG, dan PPG dibandingkan dengan add-on placebo untuk TZD (Tabel 5). Proporsi pasien yang berhenti karena kurangnya kontrol glikemik atau yang diselamatkan karena memenuhi kriteria glikemik yang telah ditentukan adalah 10% pada add-on Onglyza 2,5 mg pada kelompok TZD, 6% untuk add-on Onglyza 5 mg ke grup TZD, dan 10% pada add-on placebo pada TZD kelompok.
Tabel 5: Parameter Glikememik pada Minggu ke-24 dalam Studi Onglyza yang Dikontrol dengan Plasebo sebagai Terapi Kombinasi Tambahan dengan Thiazolidinedione *
| Parameter kemanjuran | Onglyza 2,5 mg + TZD N = 195 |
Onglyza 5 mg + TZD N = 186 |
Placebo + TZD N = 184 |
|---|---|---|---|
| * Populasi yang ingin diobati menggunakan pengamatan terakhir pada penelitian atau pengamatan terakhir sebelum terapi penyelamatan metformin untuk pasien yang membutuhkan penyelamatan. | |||
| †Kuadrat terkecil berarti disesuaikan dengan nilai awal. | |||
| c p-value <0,0001 dibandingkan dengan plasebo + TZD | |||
| § p-value <0,05 dibandingkan dengan plasebo + TZD | |||
| Hemoglobin A1C (%) | N = 192 | N = 183 | N = 180 |
| Baseline (rata-rata) | 8.3 | 8.4 | 8.2 |
| Ubah dari baseline (rata-rata yang disesuaikan†) | −0.7 | −0.9 | −0.3 |
| Perbedaan dari plasebo (rata-rata yang disesuaikan†) | −0.4 § | −0.6c | |
| Interval Keyakinan 95% | (−0.6, −0.2) | (−0.8, −0.4) | |
| Persen pasien yang mencapai A1C <7% | 42% §(81/192) | 42% §(77/184) | 26% (46/180) |
| Glukosa Plasma Puasa (mg / dL) | N = 193 | N = 185 | N = 181 |
| Baseline (rata-rata) | 163 | 160 | 162 |
| Ubah dari baseline (rata-rata yang disesuaikan†) | −14 | −17 | −3 |
| Perbedaan dari plasebo (rata-rata yang disesuaikan†) | −12 § | −15 § | |
| Interval Keyakinan 95% | (−20, −3) | (−23, −6) | |
| 2 jam Postprandial Glucose (mg / dL) | N = 156 | N = 134 | N = 127 |
| Baseline (rata-rata) | 296 | 303 | 291 |
| Ubah dari baseline (rata-rata yang disesuaikan†) | −55 | −65 | −15 |
| Perbedaan dari plasebo (rata-rata yang disesuaikan†) | −40 § | −50 § | |
| Interval Keyakinan 95% | (−56, −24) | (−66, −34) |
Terapi Kombinasi Tambahan dengan Glyburide
Sebanyak 768 pasien dengan diabetes tipe 2 berpartisipasi dalam uji coba terkontrol plasebo terkontrol plasebo 24 minggu yang dilakukan secara acak selama 24 minggu ini untuk mengevaluasi kemanjuran dan keamanan Onglyza dalam kombinasi dengan sulfonylurea (SU) pada pasien dengan kontrol glikemik yang tidak memadai saat pendaftaran (A1C A1 ¥ 7,5% hingga ‰ ¤ 10%) pada dosis submaksimal SU sendirian. Untuk memenuhi syarat untuk pendaftaran, pasien diminta untuk menggunakan SU dosis submaksimal selama 2 bulan atau lebih. Dalam studi ini, Onglyza dalam kombinasi dengan dosis tetap, sedang dari SU dibandingkan dengan titrasi ke dosis yang lebih tinggi dari SU.
Pasien yang memenuhi kriteria kelayakan terdaftar dalam periode single-blind, 4 minggu, diet dan olahraga, dan diberikan glyburide 7,5 mg sekali sehari. Setelah periode awal, pasien yang memenuhi syarat dengan A1C â ‰ ¥ 7% hingga â ‰ ¤10% diacak ke 2,5 mg atau 5 mg Onglyza add-on untuk 7,5 mg glyburide atau ke plasebo ditambah total dosis harian 10 mg glyburide. Pasien yang menerima plasebo memenuhi syarat untuk mendapatkan glikida yang dititrasi ke total dosis harian 15 mg. Up-titrasi glyburide tidak diizinkan pada pasien yang menerima Onglyza 2,5 mg atau 5 mg. Glyburide dapat dititrasi ke bawah pada kelompok perawatan apa saja satu kali selama masa studi 24 minggu karena hipoglikemia sebagaimana dianggap perlu oleh peneliti. Kira-kira 92% pasien dalam kelompok plasebo plus glybide dititrasi ke dosis harian total 15 mg selama 4 minggu pertama masa studi. Pasien yang gagal memenuhi tujuan glikemik spesifik selama penelitian dirawat dengan penyelamatan metformin, ditambahkan pada obat studi yang ada. Titrasi dosis Onglyza tidak diizinkan selama penelitian.
Dalam kombinasi dengan glyburide, Onglyza 2,5 mg dan 5 mg memberikan peningkatan yang signifikan dalam A1C, FPG, dan PPG dibandingkan dengan plasebo ditambah kelompok glburide yang dititrasi (Tabel 6). Proporsi pasien yang berhenti karena kurangnya kontrol glikemik atau yang diselamatkan untuk memenuhi kriteria glikemik yang ditentukan sebelumnya adalah 18% di add-on Onglyza 2,5 mg untuk kelompok glburida, 17% dalam add-on Onglyza 5 mg untuk grup glburida, dan 30% dalam plasebo ditambah dengan up-titrasi glybide kelompok.
Tabel 6: Parameter Glikememik pada Minggu ke-24 dalam Studi Onglyza yang Dikontrol Plasebo sebagai Terapi Kombinasi Tambahan dengan Glyburide *
| Parameter kemanjuran | Onglyza 2,5 mg + Glyburide 7,5 mg N = 248 |
Onglyza 5 mg + Glyburide 7,5 mg N = 253 |
Placebo + Glyburide Ditingkatkan N = 267 |
|---|---|---|---|
| * Populasi yang ingin diobati menggunakan pengamatan terakhir pada penelitian atau pengamatan terakhir sebelum terapi penyelamatan metformin untuk pasien yang membutuhkan penyelamatan. | |||
| †Kuadrat terkecil berarti disesuaikan dengan nilai awal. | |||
| c p-value <0,0001 dibandingkan dengan plasebo + naik glikida titrasi | |||
| § p-value <0,05 dibandingkan dengan plasebo + naik glikida titrasi | |||
| Hemoglobin A1C (%) | N = 246 | N = 250 | N = 264 |
| Baseline (rata-rata) | 8.4 | 8.5 | 8.4 |
| Ubah dari baseline (rata-rata yang disesuaikan†) | −0.5 | −0.6 | +0.1 |
| Perbedaan dari up-titrasi glyburide (rata-rata yang disesuaikan†) | −0.6c | −0.7c | |
| Interval Keyakinan 95% | (−0.8, −0.5) | (−0.9, −0.6) | |
| Persen pasien yang mencapai A1C <7% | 22% §(55/246) | 23% §(57/250) | 9% (24/264) |
| Glukosa Plasma Puasa (mg / dL) | N = 247 | N = 252 | N = 265 |
| Baseline (rata-rata) | 170 | 175 | 174 |
| Ubah dari baseline (rata-rata yang disesuaikan†) | −7 | −10 | +1 |
| Perbedaan dari up-titrasi glyburide (rata-rata yang disesuaikan†) | −8 § | −10 § | |
| Interval Keyakinan 95% | (−14, −1) | (−17, −4) | |
| 2 jam Postprandial Glucose (mg / dL) | N = 195 | N = 202 | N = 206 |
| Baseline (rata-rata) | 309 | 315 | 323 |
| Ubah dari baseline (rata-rata yang disesuaikan†) | −31 | −34 | +8 |
| Perbedaan dari up-titrasi glyburide (rata-rata yang disesuaikan†) | −38 § | −42 § | |
| Interval Keyakinan 95% | (−50, −27) | (−53, −31) |
Penggunaan bersama dengan Metformin pada Pasien yang belum pernah menggunakan pengobatan
Sebanyak 1.306 pasien yang belum pernah menggunakan pengobatan dengan diabetes mellitus tipe 2 berpartisipasi dalam uji coba terkontrol secara acak, tersamar ganda, terkontrol plasebo selama 24 minggu ini. mengevaluasi kemanjuran dan keamanan Onglyza yang diberikan bersama dengan metformin pada pasien dengan kontrol glikemik yang tidak adekuat (A1C - 8% hingga 8% sampai 12%) pada diet dan olahraga sendirian. Pasien diminta untuk naif pengobatan untuk terdaftar dalam penelitian ini.
Pasien yang memenuhi kriteria kelayakan didaftar dalam periode single-blind, 1 minggu, diet dan latihan memimpin plasebo. Pasien diacak ke salah satu dari empat kelompok pengobatan: Onglyza 5 mg + metformin 500 mg, saxagliptin 10 mg + metformin 500 mg, saxagliptin 10 mg + plasebo, atau metformin 500 mg + plasebo. Onglyza diberi dosis sekali sehari. Dalam 3 kelompok perlakuan yang menggunakan metformin, dosis metformin ditingkatkan setiap minggu dalam peningkatan 500 mg per hari, sebagaimana ditoleransi, hingga maksimum 2000 mg per hari berdasarkan FPG. Pasien yang gagal memenuhi tujuan glikemik spesifik selama penelitian diobati dengan penyelamatan pioglitazone sebagai terapi tambahan.
Pemberian Onglyza 5 mg plus metformin memberikan peningkatan signifikan pada A1C, FPG, dan PPG dibandingkan dengan plasebo plus metformin (Tabel 7).
Tabel 7: Parameter Glikememik pada Minggu ke 24 dalam Percobaan Kontrol Onglyza Koadministrasi yang Terkontrol Plasebo dengan Metformin pada Pasien naif Pengobatan
| Parameter kemanjuran | Onglyza 5 mg + Metformin N = 320 |
Placebo + Metformin N = 328 |
|---|---|---|
| * Populasi yang ingin diobati menggunakan pengamatan terakhir pada penelitian atau pengamatan terakhir sebelum terapi penyelamatan pioglitazone untuk pasien yang membutuhkan penyelamatan. | ||
| †Kuadrat terkecil berarti disesuaikan dengan nilai awal. | ||
| c p-value <0,0001 dibandingkan dengan plasebo + metformin | ||
| § nilai p <0,05 dibandingkan dengan plasebo + metformin | ||
| Hemoglobin A1C (%) | N = 306 | N = 313 |
| Baseline (rata-rata) | 9.4 | 9.4 |
| Ubah dari baseline (rata-rata yang disesuaikan†) | −2.5 | −2.0 |
| Perbedaan dari plasebo + metformin (rata-rata yang disesuaikan†) | −0.5c | |
| Interval Keyakinan 95% | (−0.7, −0.4) | |
| Persen pasien yang mencapai A1C <7% | 60% §(185/307) | 41% (129/314) |
| Glukosa Plasma Puasa (mg / dL) | N = 315 | N = 320 |
| Baseline (rata-rata) | 199 | 199 |
| Ubah dari baseline (rata-rata yang disesuaikan†) | −60 | −47 |
| Perbedaan dari plasebo + metformin (rata-rata yang disesuaikan†) | −13 § | |
| Interval Keyakinan 95% | (−19, −6) | |
| 2 jam Postprandial Glucose (mg / dL) | N = 146 | N = 141 |
| Baseline (rata-rata) | 340 | 355 |
| Ubah dari baseline (rata-rata yang disesuaikan†) | −138 | −97 |
| Perbedaan dari plasebo + metformin (rata-rata yang disesuaikan†) | −41 § | |
| Interval Keyakinan 95% | (−57, −25) |
teratas
Bagaimana Disediakan
Tablet Onglyza ™ (saxagliptin) memiliki tanda di kedua sisi dan tersedia dalam kekuatan dan paket yang tercantum dalam Tabel 8.
| Tablet Kekuatan |
Tablet Dilapisi Film Warna / bentuk |
Tablet Tanda |
Ukuran paket | Kode NDC |
|---|---|---|---|---|
| 5 mg | Merah Jambu bikonveks, bulat |
"5" di satu sisi dan "4215" di terbalik, dengan tinta biru | Botol 30 Botol 90 Botol 500 Blister 100 |
0003-4215-11 0003-4215-21 0003-4215-31 0003-4215-41 |
| 2,5 mg | kuning pucat hingga kuning muda bikonveks, bulat |
"2.5" di satu sisi dan "4214" di terbalik, dengan tinta biru | Botol 30 Botol 90 |
0003-4214-11 0003-4214-21 |
Penyimpanan dan penanganan
Simpan pada 20 ° -25 ° C (68 ° -77 ° F); kunjungan diizinkan ke 15 ° -30 ° C (59 ° -86 ° F) [lihat USP Controlled Room Temperature].
teratas
Terakhir Diperbarui: 07/09
E.R. Squibb & Sons, L.L.C.
Informasi pasien Onglyza
Info Lengkap tentang Tanda, Gejala, Penyebab, Perawatan Diabetes
Informasi dalam monograf ini tidak dimaksudkan untuk mencakup semua kemungkinan penggunaan, arahan, tindakan pencegahan, interaksi obat atau efek samping. Informasi ini digeneralisasi dan tidak dimaksudkan sebagai saran medis khusus. Jika Anda memiliki pertanyaan tentang obat-obatan yang Anda pakai atau ingin informasi lebih lanjut, tanyakan kepada dokter, apoteker, atau perawat Anda.
kembali ke: Telusuri semua Obat untuk Diabetes

