Starlix untuk Perawatan Diabetes
Nama Merek: Starlix
Nama Umum: tablet nateglinide
Isi:
Deskripsi
Farmakologi Klinis
Studi Klinis
Indikasi dan Penggunaan
Kontraindikasi
Tindakan pencegahan
Reaksi yang merugikan
Overdosis
Dosis dan Administrasi
Bagaimana Disediakan
Starlix, nateglinide, informasi pasien lengkap (dalam Bahasa Inggris)
Deskripsi
Starlix® (nateglinide) adalah agen antidiabetik oral yang digunakan dalam pengelolaan diabetes mellitus tipe 2 [juga dikenal sebagai diabetes mellitus (NIDDM) yang tidak tergantung insulin atau diabetes onset dewasa]. Starlix, (-) - N - [(trans-4-isopropylcyclohexane) karbonil] -D-fenilalanin, secara struktural tidak terkait dengan sekretagog insulin sulfonilurea oral.
Rumus struktural seperti yang ditunjukkan
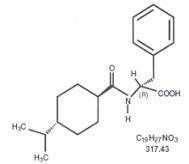
Nateglinide adalah bubuk putih dengan berat molekul 317,43. Ini mudah larut dalam metanol, etanol, dan kloroform, larut dalam eter, sedikit larut dalam asetonitril dan oktanol, dan praktis tidak larut dalam air. Tablet Starlix biconvex mengandung 60 mg, atau 120 mg, nateglinide untuk pemberian oral.
Bahan tidak aktif: silikon dioksida koloid, natrium croscarmellose, hidroksipropil metilselulosa, oksida besi (merah atau kuning), laktosa monohidrat, magnesium stearat, selulosa mikrokristalin, polietilen glikol, povidone, bedak, dan titanium dioksida.
teratas
Farmakologi Klinis
Mekanisme aksi
Nateglinide adalah turunan asam amino yang menurunkan kadar glukosa darah dengan merangsang sekresi insulin dari pankreas. Tindakan ini tergantung pada fungsi sel-sel beta di pulau pankreas. Nateglinide berinteraksi dengan saluran kalium peka-ATP (K + ATP) pada sel beta pankreas. Depolarisasi sel beta berikutnya membuka saluran kalsium, menghasilkan masuknya kalsium dan sekresi insulin. Tingkat pelepasan insulin tergantung pada glukosa dan berkurang pada kadar glukosa yang rendah. Nateglinide sangat selektif jaringan dengan afinitas rendah untuk jantung dan otot rangka.
Farmakokinetik
Penyerapan
Setelah pemberian oral segera sebelum makan, nateglinide cepat diserap dengan konsentrasi obat puncak plasma rata-rata (Cmax) yang umumnya terjadi dalam 1 jam (Tmax) setelah pemberian dosis. Ketika diberikan kepada pasien dengan diabetes tipe 2 pada kisaran dosis 60 mg hingga 240 mg tiga kali sehari untuk satu minggu, nateglinide menunjukkan farmakokinetik linier untuk AUC (area di bawah kurva konsentrasi waktu / plasma) dan Cmax. Tmax juga ditemukan tidak tergantung pada dosis pada populasi pasien ini. Ketersediaan hayati absolut diperkirakan sekitar 73%. Ketika diberikan dengan atau setelah makan, tingkat penyerapan nateglinide (AUC) tetap tidak terpengaruh. Namun, ada keterlambatan dalam laju penyerapan yang ditandai oleh penurunan Cmax dan keterlambatan waktu untuk memuncak konsentrasi plasma (Tmax). Profil plasma ditandai oleh beberapa puncak konsentrasi plasma ketika nateglinide diberikan dalam kondisi puasa. Efek ini berkurang ketika nateglinide dikonsumsi sebelum makan.
Distribusi
Berdasarkan data setelah pemberian nateglinide intravena (IV), volume tunak distribusi nateglinide diperkirakan sekitar 10 liter pada subyek sehat. Nateglinide terikat secara luas (98%) dengan protein serum, terutama albumin serum, dan pada tingkat lebih rendah Î ± 1 glikoprotein asam. Tingkat pengikatan protein serum tidak tergantung pada konsentrasi obat pada kisaran uji 0,1-10 μg / mL.
Metabolisme
Nateglinide dimetabolisme oleh sistem oksidase fungsi campuran sebelum eliminasi. Rute utama metabolisme adalah hidroksilasi diikuti oleh konjugasi glukuronida. Metabolit utama adalah agen antidiabetik yang kurang kuat daripada nateglinide. Metabolit isoprena minor memiliki potensi yang mirip dengan senyawa induk nateglinide.
Data in vitro menunjukkan bahwa nateglinide sebagian besar dimetabolisme oleh sitokrom P450 isoenzim CYP2C9 (70%) dan CYP3A4 (30%).
Pengeluaran
Nateglinide dan metabolitnya dengan cepat dan sepenuhnya dihilangkan setelah pemberian oral. Dalam 6 jam setelah pemberian dosis, sekitar 75% dari 14C-nateglinide yang diberikan ditemukan dalam urin. Delapan puluh tiga persen dari 14C-nateglinide diekskresikan dalam urin dengan tambahan 10% dieliminasi dalam tinja. Sekitar 16% dari 14C-nateglinide diekskresikan dalam urin sebagai senyawa induk. Dalam semua penelitian sukarelawan sehat dan pasien dengan diabetes tipe 2, konsentrasi plasma nateglinide menurun dengan cepat dengan waktu paruh eliminasi rata-rata sekitar 1,5 jam. Konsisten dengan waktu paruh eliminasi yang singkat ini, tidak ada akumulasi nateglinide setelah pemberian berulang hingga 240 mg tiga kali sehari selama 7 hari.
Interaksi obat
Studi metabolisme obat in vitro menunjukkan bahwa Starlix sebagian besar dimetabolisme oleh sitokrom P450 isozim CYP2C9 (70%) dan pada tingkat lebih rendah CYP3A4 (30%). Starlix adalah inhibitor potensial isoenzim CYP2C9 in vivo seperti yang ditunjukkan oleh kemampuannya untuk menghambat metabolisme in-vitro tolbutamide. Penghambatan reaksi metabolik CYP3A4 tidak terdeteksi dalam percobaan in vitro.
Glyburide: Dalam studi crossover dosis ganda yang dilakukan secara acak, pasien dengan diabetes tipe 2 adalah diberikan 120 mg Starlix tiga kali sehari sebelum makan selama 1 hari dalam kombinasi dengan glyburide 10 mg setiap hari. Tidak ada perubahan yang relevan secara klinis dalam farmakokinetik dari kedua agen.
Metformin: Ketika Starlix 120 mg tiga kali sehari sebelum makan diberikan dalam kombinasi dengan metformin 500 mg tiga kali sehari untuk pasien dengan diabetes tipe 2, tidak ada perubahan yang relevan secara klinis dalam farmakokinetik agen.
Digoxin: Ketika Starlix 120 mg sebelum makan diberikan dalam kombinasi dengan dosis tunggal 1 mg digoxin menjadi sukarelawan sehat, tidak ada perubahan yang relevan secara klinis dalam farmakokinetik keduanya agen.
Warfarin: Ketika subyek sehat diberikan Starlix 120 mg tiga kali sehari sebelum makan selama empat hari kombinasi dengan dosis tunggal warfarin 30 mg pada hari ke 2, tidak ada perubahan dalam farmakokinetik dari kedua agen. Waktu protrombin tidak terpengaruh.
Diklofenak: Pemberian dosis Starlix 120 mg pagi dan makan siang dalam kombinasi dengan 75 mg tunggal dosis diklofenak pada sukarelawan sehat tidak menghasilkan perubahan signifikan pada farmakokinetik keduanya agen.
Populasi Khusus
Geriatri: Usia tidak memengaruhi sifat farmakokinetik nateglinide. Oleh karena itu, tidak diperlukan penyesuaian dosis untuk pasien usia lanjut.
Jenis kelamin: Tidak ada perbedaan klinis yang signifikan dalam farmakokinetik nateglinide yang diamati antara pria dan wanita. Karena itu, tidak perlu penyesuaian dosis berdasarkan jenis kelamin.
Ras: Hasil dari analisis farmakokinetik populasi termasuk subjek Kaukasia, Hitam, dan asal etnis lainnya menunjukkan bahwa ras memiliki sedikit pengaruh pada farmakokinetik nateglinide.
Kerusakan Ginjal: Dibandingkan dengan subyek yang sehat dan cocok, pasien dengan diabetes tipe 2 dan insufisiensi ginjal sedang-berat (CrCl 15-50 mL / mnt) tidak pada dialisis yang tampak jelas serupa izin, AUC, dan Cmax. Pasien dengan diabetes tipe 2 dan gagal ginjal pada dialisis menunjukkan penurunan paparan obat secara keseluruhan. Namun, pasien hemodialisis juga mengalami penurunan pengikatan protein plasma dibandingkan dengan sukarelawan sehat yang cocok.
Kerusakan hati: Puncak dan paparan total nateglinide pada subyek non-diabetes dengan insufisiensi hati ringan meningkat sebesar 30% dibandingkan dengan subyek sehat yang cocok. Starlix® (nateglinide) harus digunakan dengan hati-hati pada pasien dengan penyakit hati kronis. (Lihat PENCEGAHAN, Gangguan Hati.)
Farmakodinamik
Starlix cepat diserap dan merangsang sekresi insulin pankreas dalam waktu 20 menit setelah pemberian oral. Ketika Starlix diberi dosis tiga kali sehari sebelum makan, ada peningkatan cepat dalam insulin plasma, dengan tingkat puncaknya sekitar 1 jam setelah pemberian dosis dan turun ke garis dasar sebanyak 4 jam setelah pemberian dosis.
Dalam uji klinis double-blind, terkontrol di mana Starlix diberikan sebelum masing-masing tiga makanan, kadar glukosa plasma ditentukan selama 12 jam, periode siang hari setelah 7 minggu pengobatan. Starlix diberikan 10 menit sebelum makan. Makanan didasarkan pada menu perawatan berat badan diabetes standar dengan total konten kalori berdasarkan tinggi badan masing-masing subjek. Starlix menghasilkan penurunan glikemia puasa dan postprandial yang signifikan secara statistik dibandingkan dengan plasebo.
teratas
Studi Klinis
Sebanyak 3.566 pasien diacak dalam sembilan studi double-blind, placebo, atau active-controlled selama 8 hingga 24 minggu untuk mengevaluasi keamanan dan kemanjuran Starlix® (nateglinide). 3.513 pasien memiliki nilai efikasi di luar garis dasar. Dalam studi ini Starlix diberikan hingga 30 menit sebelum masing-masing dari tiga makanan utama setiap hari.
Starlix® Monotherapy Dibandingkan dengan Placebo
Dalam studi 24 minggu secara acak, tersamar ganda, terkontrol plasebo, pasien dengan diabetes tipe 2 dengan HbA1C â ‰ ¥ 6,8% pada diet saja secara acak menerima Starlix (60 mg atau 120 mg tiga kali sehari sebelum makan) atau plasebo. Baseline HbA1C berkisar antara 7,9% hingga 8,1% dan 77,8% pasien sebelumnya tidak diobati dengan terapi antidiabetik oral. Pasien yang sebelumnya diobati dengan obat antidiabetes diharuskan untuk menghentikan obat itu setidaknya 2 bulan sebelum pengacakan. Penambahan Starlix sebelum makan menghasilkan penurunan yang signifikan secara statistik dalam rata-rata HbA1C dan rata-rata glukosa plasma puasa (FPG) dibandingkan dengan plasebo (lihat Tabel 1). Pengurangan HbA1C dan FPG adalah serupa untuk pasien yang belum pernah, dan mereka yang sebelumnya terpapar obat antidiabetes.
Dalam penelitian ini, satu episode hipoglikemia berat (glukosa plasma <36 mg / dL) dilaporkan pada pasien yang diobati dengan Starlix 120 mg tiga kali sehari sebelum makan. Tidak ada pasien yang mengalami hipoglikemia yang membutuhkan bantuan pihak ketiga. Pasien yang diobati dengan Starlix memiliki peningkatan rata-rata yang signifikan secara statistik dalam berat dibandingkan dengan plasebo (lihat Tabel 1).
Dalam studi acak, double-blind, 24-minggu, aktif dan terkontrol plasebo lainnya, pasien dengan diabetes tipe 2 secara acak menerima Starlix (120 mg tiga kali setiap hari sebelum makan), metformin 500 mg (tiga kali sehari), kombinasi Starlix 120 mg (tiga kali sehari sebelum makan) dan metformin 500 mg (tiga kali sehari), atau plasebo. Baseline HbA1C berkisar antara 8,3% hingga 8,4%. Lima puluh tujuh persen pasien sebelumnya tidak diobati dengan terapi antidiabetik oral. Monoterapi Starlix menghasilkan penurunan yang signifikan dalam rata-rata HbA1C dan rata-rata FPG dibandingkan dengan plasebo yang serupa dengan hasil penelitian yang dilaporkan di atas (lihat Tabel 2).
Tabel 1: Hasil titik akhir untuk studi 24 minggu, dosis tetap dari monoterapi Starlix®
|
Placebo |
Starlix® 60 mg tiga kali harian sebelum makan |
Starlix® 120 mg tiga kali harian sebelum makan |
|
| HbA1C (%) | N = 168 | N = 167 | N = 168 |
| Baseline (rata-rata) | 8.0 | 7.9 | 8.1 |
| Ubah dari garis dasar (rata-rata) | +0.2 | -0.3 | -0.5 |
| Perbedaan dari plasebo (rata-rata) | -0.5 Sebuah | -0.7 Sebuah | |
| FPG (mg / dL) | N = 172 | N = 171 | N = 169 |
| Baseline (rata-rata) | 167.9 | 161.0 | 166.5 |
| Ubah dari garis dasar (rata-rata) | +9.1 | +0.4 | -4.5 |
| Perbedaan dari plasebo (rata-rata) | -8.7 Sebuah | -13.6 Sebuah | |
| Berat (kg) | N = 170 | N = 169 | N = 166 |
| Baseline (rata-rata) | 85.8 | 83.7 | 86.3 |
| Ubah dari garis dasar (rata-rata) | -0.7 | +0.3 | +0.9 |
| Perbedaan dari plasebo (rata-rata) | +1.0 Sebuah | +1.6 Sebuah |
nilai p â ‰ ¤ 0,004
Starlix® Monotherapy Dibandingkan dengan Agen Antidiabetik Oral Lainnya
Glyburide
Dalam 24 minggu, double-blind, uji coba terkontrol aktif, pasien dengan diabetes tipe 2 yang telah menggunakan sulfonylurea selama â ‰ ¥ 3 bulan dan yang memiliki HbA1C pada awal â ‰ ¥ 6,5% secara acak untuk menerima Starlix (60 mg atau 120 mg tiga kali sehari sebelum makan) atau glyburide 10 mg sekali harian. Pasien yang diacak untuk Starlix mengalami peningkatan yang signifikan dalam rata-rata HbA1C dan rata-rata FPG pada titik akhir dibandingkan dengan pasien yang diacak dengan glyburide.
Metformin
Dalam studi acak, double-blind, 24-minggu, aktif dan terkontrol plasebo lainnya, pasien dengan diabetes tipe 2 secara acak menerima Starlix (120 mg tiga kali setiap hari sebelum makan), metformin 500 mg (tiga kali sehari), kombinasi Starlix 120 mg (tiga kali sehari sebelum makan) dan metformin 500 mg (tiga kali sehari), atau plasebo. Baseline HbA1C berkisar antara 8,3% hingga 8,4%. Lima puluh tujuh persen pasien sebelumnya tidak diobati dengan terapi antidiabetik oral. Penurunan rata-rata HbA1C dan FPG rata-rata pada titik akhir dengan metformin monoterapi secara signifikan lebih besar daripada penurunan variabel-variabel ini dengan monoterapi Starlix (lihat Tabel 2). Relatif terhadap plasebo, monoterapi Starlix dikaitkan dengan peningkatan signifikan dalam berat rata-rata sedangkan monoterapi metformin dikaitkan dengan penurunan signifikan dalam berat rata-rata. Di antara subset pasien yang belum menjalani terapi antidiabetik, pengurangan rata-rata HbA1C dan rata-rata FPG untuk monoterapi Starlix serupa dengan yang untuk monoterapi metformin (lihat Tabel 2). Di antara subset dari pasien yang sebelumnya diobati dengan agen antidiabetik lainnya, terutama glybbide, HbA1C di Starlix kelompok monoterapi sedikit meningkat dari awal, sedangkan HbA1C berkurang pada kelompok monoterapi metformin (lihat Tabel 2).
Terapi Kombinasi Starlix®
Metformin
Dalam studi acak, double-blind, 24-minggu, aktif dan terkontrol plasebo lainnya, pasien dengan diabetes tipe 2 secara acak menerima Starlix (120 mg tiga kali setiap hari sebelum makan), metformin 500 mg (tiga kali sehari), kombinasi Starlix 120 mg (tiga kali sehari sebelum makan) dan metformin 500 mg (tiga kali sehari), atau plasebo. Baseline HbA1C berkisar antara 8,3% hingga 8,4%. Lima puluh tujuh persen pasien sebelumnya tidak diobati dengan terapi antidiabetik oral. Pasien yang sebelumnya diobati dengan obat antidiabetes diharuskan untuk menghentikan pengobatan setidaknya 2 bulan sebelum pengacakan. Kombinasi Starlix dan metformin menghasilkan penurunan HbA1C dan FPG yang secara statistik lebih besar secara signifikan dibandingkan dengan Starlix atau metformin monoterapi (lihat Tabel 2). Starlix, sendirian atau dalam kombinasi dengan metformin, secara signifikan mengurangi peningkatan glukosa prandial dari sebelum makan menjadi 2 jam setelah makan dibandingkan dengan plasebo dan metformin saja.
Dalam penelitian ini, satu episode hipoglikemia berat (glukosa plasma ‰ ¤ 36 mg / dL) dilaporkan pada pasien yang menerima kombinasi Starlix dan metformin dan empat episode hipoglikemia berat dilaporkan pada satu pasien di metformin kelompok pengobatan. Tidak ada pasien yang mengalami episode hipoglikemia yang membutuhkan bantuan pihak ketiga. Dibandingkan dengan plasebo, monoterapi Starlix dikaitkan dengan peningkatan berat badan yang signifikan secara statistik, sementara tidak ada perubahan signifikan dalam berat badan yang diamati dengan terapi Starlix dan metformin gabungan (lihat Tabel 2).
Dalam 24 minggu, double-blind, uji coba terkontrol plasebo, pasien dengan diabetes tipe 2 dengan HbA1C â ‰ ¥ 6,8% setelah pengobatan dengan metformin (â ‰ ¥ 1500 mg setiap hari selama ‰ ¥ 1 bulan) pertama kali dimasukkan ke dalam empat minggu periode berjalan monoterapi metformin (2000 mg setiap hari) dan kemudian diacak untuk menerima Starlix (60 mg atau 120 mg tiga kali sehari sebelum makan) atau plasebo selain metformin. Terapi kombinasi dengan Starlix dan metformin dikaitkan dengan penurunan yang secara signifikan lebih besar secara statistik HbA1C dibandingkan dengan metformin monoterapi (-0,4% dan -0,6% untuk Starlix 60 mg dan Starlix 120 mg plus metformin, masing-masing).
Tabel 2: Hasil titik akhir untuk studi 24-minggu Starlix®monotherapy dan kombinasi dengan metformin
|
Placebo |
Starlix® 120 mg tiga kali setiap hari sebelumnya makanan |
Metformin 500 mg tiga kali harian |
Starlix® 120 mg sebelum makan plus Metformin * |
|
| HbA1C (%) | ||||
| Semua | N = 160 | N = 171 | N = 172 | N = 162 |
| Baseline (rata-rata) | 8.3 | 8.3 | 8.4 | 8.4 |
| Ubah dari garis dasar (rata-rata) | +0.4 | -0.4 bc | -0.8 c | -1.5 |
| Perbedaan dari plasebo | -0.8 Sebuah | -1.2 Sebuah | -1.9 Sebuah | |
| NaÑ — ve | N = 98 | N = 99 | N = 98 | N = 81 |
| Baseline (rata-rata) | 8.2 | 8.1 | 8.3 | 8.2 |
| Ubah dari garis dasar (rata-rata) | +0.3 | -0.7 c | -0.8 c | -1.6 |
| Perbedaan dari plasebo | -1.0 Sebuah | -1.1 Sebuah | -1.9 Sebuah | |
| Non-NaÑ — ve | N = 62 | N = 72 | N = 74 | N = 81 |
| Baseline (rata-rata) | 8.3 | 8.5 | 8.7 | 8.7 |
| Ubah dari garis dasar (rata-rata) | +0.6 | +0.004 bc | -0.8 c | -1.4 |
| Perbedaan dari plasebo | -0.6 Sebuah | -1.4 Sebuah | -2.0 Sebuah | |
| FPG (mg / dL) | ||||
| Semua | N = 166 | N = 173 | N = 174 | N = 167 |
| Baseline (rata-rata) | 194.0 | 196.5 | 196.0 | 197.7 |
| Ubah dari garis dasar (rata-rata) | +8.0 | -13.1 bc | -30.0 c | -44.9 |
| Perbedaan dari plasebo | -21.1 Sebuah | -38.0 Sebuah | -52.9 Sebuah | |
| Berat (kg) | ||||
| Semua | N = 160 | N = 169 | N = 169 | N = 160 |
| Baseline (rata-rata) | 85.0 | 85.0 | 86.0 | 87.4 |
| Ubah dari garis dasar (rata-rata) | -0.4 | +0.9 bc | -0.1 | +0.2 |
| Perbedaan dari plasebo | +1.3 Sebuah | +0.3 | +0.6 |
nilai p â â ¤ 0,05 vs plasebo
b p-value â ‰ ¤ 0,03 vs metformin
c p-value â ‰ ¤ 0,05 vs kombinasi
* Metformin diberikan tiga kali sehari
Rosiglitazone
Uji coba multisenter double blind, multisenter, terkontrol plasebo selama 24 minggu dilakukan pada pasien dengan Tipe 2 diabetes tidak terkontrol secara memadai setelah respons terapeutik terhadap monoterapi rosiglitazone 8 mg harian. Penambahan Starlix (120 mg tiga kali sehari dengan makanan) dikaitkan dengan penurunan HbA1C yang secara statistik lebih besar secara signifikan dibandingkan dengan monoterapi rosiglitazone. Perbedaannya adalah -0,77% pada 24 minggu. Perubahan rata-rata berat dari awal adalah sekitar +3 kg untuk pasien yang diobati dengan Starlix plus rosiglitazone vs sekitar +1 kg untuk pasien yang diobati dengan plasebo plus rosiglitazone.
Glyburide
Dalam sebuah studi 12 minggu dari pasien dengan diabetes tipe 2 yang tidak cukup terkontrol pada glyburide 10 mg sekali sehari, penambahan Starlix (60 mg atau 120 mg tiga kali sehari sebelum makan) tidak menghasilkan tambahan manfaat.
teratas
Indikasi dan Penggunaan
Starlix® (nateglinide) diindikasikan sebagai tambahan untuk diet dan olahraga untuk meningkatkan kontrol glikemik pada orang dewasa dengan diabetes mellitus tipe 2.
teratas
Kontraindikasi
Starlix® (nateglinide) dikontraindikasikan pada pasien dengan:
1. Diketahui hipersensitif terhadap obat atau bahan yang tidak aktif.
2. Diabetes tipe 1.
3. Ketoasidosis diabetikum. Kondisi ini harus diobati dengan insulin.
teratas
Tindakan pencegahan
Hasil Makrovaskular: Belum ada penelitian klinis yang membuktikan bukti konklusif pengurangan risiko makrovaskular dengan Starlix atau obat antidiabetik lainnya.
Hipoglikemia: Semua obat penurun glukosa darah oral yang diserap secara sistemik mampu menghasilkan hipoglikemia. Frekuensi hipoglikemia berhubungan dengan keparahan diabetes, tingkat kontrol glikemik, dan karakteristik pasien lainnya. Pasien geriatri, pasien malnutrisi, dan pasien dengan insufisiensi adrenal atau hipofisis atau gangguan ginjal berat lebih rentan terhadap efek penurunan glukosa dari perawatan ini. Risiko hipoglikemia dapat meningkat dengan latihan fisik yang berat, konsumsi alkohol, asupan kalori yang tidak mencukupi secara akut atau kronis, atau kombinasi dengan antidiabetes oral lainnya agen. Hipoglikemia mungkin sulit dikenali pada pasien dengan neuropati otonom dan / atau mereka yang menggunakan beta-blocker. Starlix® (nateglinide) harus diberikan sebelum makan untuk mengurangi risiko hipoglikemia. Pasien yang tidak makan juga harus melewatkan dosis Starlix yang dijadwalkan untuk mengurangi risiko hipoglikemia.
Kerusakan hati: Starlix harus digunakan dengan hati-hati pada pasien dengan penyakit hati sedang sampai berat karena pasien tersebut belum diteliti.
Kehilangan Kontrol Glikemik
Kehilangan sementara kontrol glikemik dapat terjadi dengan demam, infeksi, trauma, atau operasi. Terapi insulin mungkin diperlukan daripada terapi Starlix pada saat-saat seperti itu. Kegagalan sekunder, atau berkurangnya efektivitas Starlix selama periode waktu tertentu, dapat terjadi.
Informasi untuk Pasien
Pasien harus diberitahu tentang potensi risiko dan manfaat Starlix dan mode terapi alternatif. Risiko dan pengelolaan hipoglikemia harus dijelaskan. Pasien harus diinstruksikan untuk mengonsumsi Starlix 1 hingga 30 menit sebelum menelan makanan, tetapi untuk melewatkan dosis yang dijadwalkan jika mereka melewatkan makan sehingga risiko hipoglikemia akan berkurang. Interaksi obat harus didiskusikan dengan pasien. Pasien harus diberitahu tentang interaksi obat-obat yang potensial dengan Starlix.
Tes laboratorium
Respons terhadap terapi harus dinilai secara berkala dengan nilai glukosa dan kadar HbA1C.
Interaksi obat
Nateglinide sangat terikat dengan protein plasma (98%), terutama albumin. Studi perpindahan in vitro dengan obat yang sangat terikat protein seperti furosemide, propranolol, kaptopril, nicardipine, pravastatin, glyburide, warfarin, phenytoin, asam asetilsalisilat, tolbutamide, dan metformin tidak menunjukkan pengaruh pada tingkat protein nateglinide mengikat. Demikian pula, nateglinide tidak memiliki pengaruh pada pengikatan protein serum propranolol, glyburide, nicardipine, warfarin, fenitoin, asam asetilsalisilat, dan tolbutamide in vitro. Namun, evaluasi yang hati-hati dari kasus individu dibenarkan dalam pengaturan klinis.
Obat-obatan tertentu, termasuk agen antiinflamasi nonsteroid (NSAID), salisilat, inhibitor monoamine oksidase, dan agen penghambat beta-adrenergik non-selektif dapat mempotensiasi aksi hipoglikemik Starlix dan antidiabetik oral lainnya narkoba.
Obat-obatan tertentu termasuk tiazid, kortikosteroid, produk tiroid, dan simpatomimetik dapat mengurangi aksi hipoglikemik Starlix dan obat antidiabetik oral lainnya.
Ketika obat ini diberikan atau ditarik dari pasien yang menerima Starlix, pasien harus diamati dengan cermat untuk perubahan dalam kontrol glikemik.
Interaksi Obat / Makanan
Farmakokinetik nateglinide tidak terpengaruh oleh komposisi makanan (protein tinggi, lemak, atau karbohidrat). Namun, kadar plasma puncak berkurang secara signifikan ketika Starlix diberikan 10 menit sebelum makan cair. Starlix tidak memiliki efek pada pengosongan lambung pada subyek sehat seperti yang dinilai dengan pengujian asetaminofen.
Karsinogenesis / Mutagenesis / Gangguan Kesuburan
Karsinogenisitas: Penelitian karsinogenisitas dua tahun pada tikus Sprague-Dawley dilakukan dengan dosis oral nateglinide hingga 900 mg / kg / hari, yang menghasilkan paparan AUC pada tikus jantan dan betina sekitar 30 dan 40 kali paparan terapeutik manusia masing-masing dengan dosis Starlix yang direkomendasikan 120 mg, tiga kali sehari sebelum makanan Sebuah studi karsinogenisitas dua tahun pada tikus B6C3F1 dilakukan dengan dosis oral nateglinide hingga 400 mg / kg / hari, yang menghasilkan paparan AUC pada pria. dan tikus betina sekitar 10 dan 30 kali paparan terapeutik manusia dengan dosis Starlix yang direkomendasikan 120 mg, tiga kali sehari sebelum makan. Tidak ada bukti respon tumorigenik yang ditemukan pada tikus atau tikus.
Mutagenesis: Nateglinide bukan genotoksik dalam uji Ames in vitro, uji limfoma tikus, uji aberasi kromosom dalam sel paru-paru hamster Tiongkok, atau dalam uji mikronukleus tikus in vivo.
Kerusakan Kesuburan: Kesuburan tidak terpengaruh oleh pemberian nateglinide pada tikus dengan dosis hingga 600 mg / kg (kira-kira 16 kali paparan terapeutik manusia dengan dosis Starlix yang direkomendasikan 120 mg tiga kali sehari sebelumnya makanan).
Kehamilan
Kategori Kehamilan C
Nateglinide tidak teratogenik pada tikus dengan dosis hingga 1000 mg / kg (sekitar 60 kali paparan terapeutik manusia dengan dosis Starlix yang direkomendasikan 120 mg, tiga kali sehari sebelum makan). Pada kelinci, perkembangan embrio dipengaruhi secara buruk dan insidensi agenesis kandung empedu atau kandung empedu kecil meningkat pada dosis 500 mg / kg (kira-kira 40 kali paparan terapeutik manusia dengan dosis Starlix yang direkomendasikan 120 mg, tiga kali sehari sebelum makanan). Tidak ada studi yang memadai dan terkontrol dengan baik pada wanita hamil. Starlix tidak boleh digunakan selama kehamilan.
Persalinan dan melahirkan
Efek Starlix pada persalinan dan pengiriman pada manusia tidak diketahui.
Menyusui Ibu
Studi pada tikus menyusui menunjukkan bahwa nateglinide diekskresikan dalam susu; rasio AUC0-48j dalam susu untuk plasma adalah sekitar 1: 4. Selama periode peri- dan postnatal, berat badan lebih rendah pada keturunan tikus yang diberi nateglinide pada 1000 mg / kg (sekitar 60 kali paparan terapeutik manusia dengan dosis Starlix yang direkomendasikan 120 mg, tiga kali sehari sebelumnya makanan). Tidak diketahui apakah Starlix diekskresikan dalam ASI. Karena banyak obat diekskresikan dalam ASI, Starlix tidak boleh diberikan kepada wanita menyusui.
Penggunaan Pediatrik
Keamanan dan efektivitas Starlix pada pasien anak belum ditetapkan.
Penggunaan Geriatri
Tidak ada perbedaan yang diamati dalam keamanan atau kemanjuran Starlix antara pasien berusia 65 tahun ke atas, dan mereka yang berusia di bawah 65 tahun. Namun, sensitivitas yang lebih besar dari beberapa individu yang lebih tua terhadap terapi Starlix tidak dapat dikesampingkan.
teratas
Reaksi yang merugikan
Dalam uji klinis, sekitar 2.600 pasien dengan diabetes tipe 2 diobati dengan Starlix® (nateglinide). Dari jumlah tersebut, sekitar 1.335 pasien dirawat selama 6 bulan atau lebih dan sekitar 190 pasien untuk satu tahun atau lebih.
Hipoglikemia relatif jarang terjadi pada semua kelompok pengobatan uji klinis. Hanya 0,3% pasien Starlix dihentikan karena hipoglikemia. Gejala gastrointestinal, terutama diare dan mual, tidak lebih umum pada pasien yang menggunakan kombinasi Starlix dan metformin daripada pada pasien yang menerima metformin saja. Demikian juga, edema perifer tidak lebih umum pada pasien yang menggunakan kombinasi Starlix dan rosiglitazone dibandingkan pada pasien yang menerima rosiglitazone saja. Tabel berikut mencantumkan peristiwa yang terjadi lebih sering pada pasien Starlix daripada pasien plasebo dalam uji klinis terkontrol.
Common Adverse Events (â ‰ ¥ 2% pada pasien Starlix®) dalam Starlix® Monotherapy Trials (% pasien)
| Placebo | Starlix® | |
| N = 458 | N = 1441 | |
| Istilah yang dipilih | ||
| Infeksi saluran pernapasan atas | 8.1 | 10.5 |
| Sakit punggung | 3.7 | 4.0 |
| Gejala Flu | 2.6 | 3.6 |
| Pusing | 2.2 | 3.6 |
| Arthropati | 2.2 | 3.3 |
| Diare | 3.1 | 3.2 |
| Trauma Terkadang | 1.7 | 2.9 |
| Bronkitis | 2.6 | 2.7 |
| Batuk | 2.2 | 2.4 |
| Hipoglikemia | 0.4 | 2.4 |
Selama pengalaman pasca-pemasaran, beberapa kasus reaksi hipersensitivitas yang jarang terjadi seperti ruam, gatal, dan urtikaria telah dilaporkan. Demikian pula, kasus-kasus penyakit kuning, hepatitis kolestatik dan peningkatan enzim hati telah dilaporkan.
Kelainan Laboratorium
Asam Urat: Ada peningkatan kadar asam urat rata-rata untuk pasien yang diobati dengan Starlix saja, Starlix dalam kombinasi dengan metformin, metformin saja, dan glyburide saja. Perbedaan masing-masing dari plasebo adalah 0,29 mg / dL, 0,45 mg / dL, 0,28 mg / dL, dan 0,19 mg / dL. Signifikansi klinis dari temuan ini tidak diketahui.
teratas
Overdosis
Dalam sebuah studi klinis pada pasien dengan diabetes tipe 2, Starlix® (nateglinide) diberikan di meningkatkan dosis hingga 720 mg sehari selama 7 hari dan tidak ada efek samping yang signifikan secara klinis dilaporkan. Tidak ada contoh overdosis dengan Starlix dalam uji klinis. Namun, overdosis dapat menyebabkan efek penurunan glukosa yang berlebihan dengan perkembangan gejala hipoglikemik. Gejala hipoglikemik tanpa kehilangan kesadaran atau temuan neurologis harus diobati dengan glukosa oral dan penyesuaian dalam dosis dan / atau pola makan. Reaksi hipoglikemik berat dengan koma, kejang, atau gejala neurologis lainnya harus diobati dengan glukosa intravena. Karena nateglinide sangat terikat protein, dialisis bukanlah cara yang efisien untuk mengeluarkannya dari darah.
teratas
Dosis dan Administrasi
Starlix® (nateglinide) harus dikonsumsi 1 hingga 30 menit sebelum makan.
Monoterapi dan Kombinasi dengan Metformin atau Thiazolidinedione
Dosis awal dan pemeliharaan Starlix yang direkomendasikan, sendiri atau dalam kombinasi dengan metformin atau thiazolidinedione, adalah 120 mg tiga kali sehari sebelum makan.
Dosis Starlix 60 mg, baik sendiri atau dalam kombinasi dengan metformin atau thiazolidinedione, dapat digunakan pada pasien yang mendekati tujuan HbA1C ketika pengobatan dimulai.
Dosis pada Pasien Geriatri
Biasanya tidak diperlukan penyesuaian dosis khusus. Namun, sensitivitas beberapa individu yang lebih besar terhadap terapi Starlix tidak dapat dikesampingkan.
Dosis pada Gangguan Ginjal dan Hati
Tidak diperlukan penyesuaian dosis pada pasien dengan insufisiensi ginjal ringan sampai berat atau pada pasien dengan insufisiensi hati ringan. Dosis pasien dengan disfungsi hati sedang sampai berat belum diteliti. Oleh karena itu, Starlix harus digunakan dengan hati-hati pada pasien dengan penyakit hati sedang sampai berat (lihat PENCEGAHAN, Penurunan fungsi hati).
teratas
Bagaimana Disediakan
Tablet Starlix® (nateglinide)
60 mg
Merah muda, bulat, tablet tepi miring dengan "Starlix" debossed di satu sisi dan "60" di sisi lain.
Botol 100... NDC 0078-0351-05
120 mg
Tablet kuning, berbentuk ovaloid dengan "Starlix" diikat di satu sisi dan "120" di sisi lainnya.
Botol 100... NDC 0078-0352-05
Penyimpanan
Simpan di 25 ºC (77 ºF); kunjungan diizinkan hingga 15 ºC-30 ºC (59 ºF-86 ºF).
Buang dalam wadah yang ketat, USP.
T2008-01
REV: JULI 2008
Diproduksi oleh:
Novartis Pharma Stein AG
Stein, Swiss
Didistribusikan oleh:
Novartis Pharmaceuticals Corporation
East Hanover, New Jersey 07936
© Novartis
Terakhir Diperbarui 07/2008
Starlix, nateglinide, informasi pasien lengkap (dalam Bahasa Inggris)
Info Lengkap tentang Tanda, Gejala, Penyebab, Perawatan Diabetes
Informasi dalam monograf ini tidak dimaksudkan untuk mencakup semua kemungkinan penggunaan, arahan, tindakan pencegahan, interaksi obat atau efek samping. Informasi ini digeneralisasi dan tidak dimaksudkan sebagai saran medis khusus. Jika Anda memiliki pertanyaan tentang obat-obatan yang Anda pakai atau ingin informasi lebih lanjut, tanyakan kepada dokter, apoteker, atau perawat Anda.
kembali ke: Telusuri semua Obat untuk Diabetes


